연구소 소개
-
49
‘5일→50일’ 인공세포막 안정성 대폭 향상
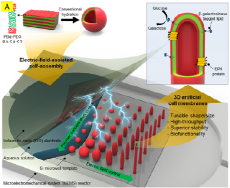
- 세포막 닮은 바이오센서 구조물 고내구성·대면적화 기술 개발 성공 - 실리콘기판에 자유자재로 3차원 형상 구현…초민감센서 구현 급물살 세포막은 세포 안팎의 보호막이자 지구상에서 가장 정확하고 정밀한 바이오센서이기도 하다. 한 면은 물과 잘 섞이는 친수성, 다른 면은 잘 섞이지 않는 소수성의 이중막 형태를 지닌 세포막은 수도꼭지처럼 이온채널을 여닫으며 외부의 물리화학적 자극을 전기신호로 바꿔 세포에 전달한다. 이에 따라 전 세계적으로 세포막의 탁월한 감지 및 정보전환 기능을 모사하는 바이오센서에 대한 연구가 활발하다. 하지만 인공 세포막 구조물의 경우 최대 5일 정도에 불과한 유지기간이 걸림돌이 되어 왔다. 한국과학기술연구원(KIST, 원장 윤석진)은 뇌과학창의연구단 김태송 박사 연구팀이 실리콘 기판 위에서 50일 넘게 안정적으로 유지되는 세포막 인공구조물 개발에 성공했다고 밝혔다. 학계에 보고된 기간 중 최장기간이다. 김태송 박사팀은 지난 2018년에도 5일 간 유지되는 인공세포막을 구현한 데 이어, 이듬해인 2019년에는 이 인공세포막 표면에 세로토닌 단백질을 결합시킨 구조체에서 양이온이 내부로 전달되는 모습을 관측하며 바이오센서로서의 응용 가능성을 확인한 바 있다. 하지만 인공세포막을 이용한 생명과학 연구와 실질적인 바이오센서 상용화를 위해서는 최소 1개월 이상의 내구성이 필수적이다. KIST 연구진은 5일 정도 수준에 머물던 인공세포막의 생존기간을 연장하기 위해 폴리머 재료의 일종인 블록코폴리머(BCP, block co-polymer)에 주목했다. 블록코폴리머는 2개 이상의 블록으로 구성된 고분자로, 인체 세포막의 친수성과 소수성처럼 서로 다른 특성의 블록을 반복적으로 길게 배열할 수 있다. 김태송 박사 연구팀은 먼저 실리콘 기판 위에 지름 8㎛(마이크로미터) 크기의 홀 수 만 개를 규칙적으로 배열한 뒤, 표면처리를 통해 각각의 홀에 일정량의 블록코폴리머 용액을 넣어 건조시키는 기술을 개발했다. 이어 이를 삽입한 극미세 유채채널의 상부 판상 전극과 하부 실리콘 기판 사이에 전기력이 작용하는 전계(electric field)를 걸어 비눗방울 모양의 블록코폴리머 이중막 구조물을 만들었다. 이는 용액의 농도와 인가되는 전계 및 주파수에 따라 특정한 모습의 구조물이 유지되는 영역의 존재를 발견한 것으로, 비눗방울 같은 구형부터 튜브 같은 원통형까지 인공세포막의 크기와 모양을 마음대로 조절할 수 있는 길을 제시한 것이다. KIST 연구진은 최종적으로 이렇게 형성한 3차원 블록코폴리머 이중막 구조물의 외부를 인체의 구성성분과 유사하며 탄력성과 복원력이 뛰어난 다공성 하이드로젤로 채워 단단히 고정함으로써 50일 이상 안정적으로 유지되는 인공세포막을 구현하는 데 성공했다. 또한 블록코폴리머 이중막 구조물로 수천 개의 튜브형 구조물(실리아)로 이뤄진 소장 내 상피세포를 모사해 인공장기 구조물을 제작하고 당류 분해효소(β-galactosidase)를 결합시켜 인공장기 소재로서의 활용 가능성도 입증했다. KIST 김태송 박사는 “지금까지 전 세계 대부분의 인공세포막 연구가 실리콘 기판 위에 2차원 평면형 구조물을 올리는 것이 대부분이었던 가운데 처음으로 3차원 인공세포막 구조물 제작 기술을 개발한 데 이어 안정적인 유지기간을 10배 이상으로 늘리는 데도 성공하게 됐다”며 “인공세포막 대량생산의 길을 제시한 이번 연구가 세포의 기능을 닮은 초고감도 바이오센서, 신약 개발을 위한 약물스크리닝, 뇌신경 전달 물질이나 호르몬 등의 역할을 규명하는 생명현상 연구의 플랫폼 기술로 더욱 발전할 수 있기를 기대하고 있다”고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙)의 지원으로 KIST 주요사업, 범부처전주기의료기기연구개발사업단, 한국연구재단 중견연구자지원사업을 통해 수행되었으며, 연구 결과는 저명 국제학술지인 네이처 커뮤니케이션즈(Nature communications) (IF : 14.919, JCR 분야 상위 4.86%) 최신호에 게재되었다. * (논문명) Tunable and scalable fabrication of block copolymer-based 3D polymorphic artificial cell membrane array - (제 1저자) 한국과학기술연구원 강동현 (전문원), 한원배 (박사후연구원) - (교신저자) 한국과학기술연구원 김태송 (책임연구원) 그림설명 A: 기판위에 상,하부 전계를 인가하여 블록코폴리머 (PBd-PEO) 농도와 전계의 조절에 의하여 다양한 크기 와 모양의 이중막 구조물 제작 모식도 B: 제작된 수많은 구형 및 튜브형 구조물들과 구조물 한 개를 확대한 측면 공초점 현미경 사진 C: 각각의 구형 및 튜브형 구조물 크기 분포
- 48
- 작성자뇌과학연구소 김태송 박사팀
- 작성일2022.03.22
- 조회수18543
-
47
채혈 않고 1ml 안되는 소변으로 전립선암 진단 실마리
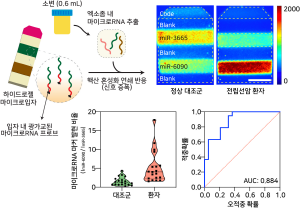
소변유래 엑소좀 내 마이크로 RNA 신호증폭 기술 개발 □ 채혈이 필요한 전립선암 진단을 1ml도 안되는 소변으로 진단하는 날이 올 수 있을까? □ 한국연구재단(이사장 노정혜)은 한국과학기술연구원 (KIST) 최낙원, 강지윤 박사, 고려대학교 봉기완 교수 공동 연구팀이 고려대학교 안암병원 비뇨의학과 강성구 교수, 심지성 교수와 협력하여 소변에 대단히 적은 양으로 존재하는 엑소좀* 내 전립선암 관련 마이크로RNA*를 검출할 수 있는 기술을 개발했다”고 밝혔다. * 엑소좀: 세포외 소포체라고도 불리며 세포들 사이 또는 세포와 외부 환경의 끊임 없는 정보 교환을 위해 중간 매개체 역할을 하는 세포 유래 물질임. 엑소좀 안에는 DNA, RNA, 단백질을 포함하고 있어 유래된 세포의 상태와 정보를 알 수 있으며, 혈액, 소변, 침, 눈물 등 다양한 체액에 존재함 * 마이크로RNA : 약 20-25개의 핵산으로 구성된 짧은 RNA의 일종으로 메신저 RNA (mRNA)와 같은 전사 (transcription) RNA의 기능이 못하도록 막거나 유전자 발현의 후전사 (post-transcription) 조절을 함 □ 불필요한 조직검사나 수술, 방사선요법을 줄이기 위해 기존 전립선암 진단에 쓰이는 혈액 내 전립선 특이 항원(PSA) 검사 보다 더 민감한 바이오마커를 개발하려는 연구가 활발하다. ○ 체액 내 엑소좀에 함유된 마이크로RNA가 다양한 질병과 연관 되어 있음이 알려지면서 전립선암 진단을 위한 마커로 엑소좀 내 마이크로 RNA가 고려되어 왔다. □ 하지만 분비되는 엑소좀이 적은데다 엑소좀 내 마이크로RNA 농도 역시 낮아 진단에 실제 활용할 수 있도록 적은 샘플에서 효율적으로 마이크로RNA를 검출할 수 있는 기술이 필요한 실정이었다. □ 이에 연구팀은 아주 적은 양의 마이크로RNA 신호를 하이드로젤 안에서 증폭하여 검출할 수 있는 기술을 개발하고 ○ 실제 이를 이용해 정상인과 전립선암 환자의 소변 샘플 0.6ml 에서 마이크로RNA 발현량 차이를 민감하게 검출해냈다. ○ 기존 PSA 검사의 경우 민감도 90% 기준 특이도 30%를 가지고 있는데 이보다 약 2.2배 높은 68%의 특이도를 보이며 이는 기존 마이크로RNA 검출법 대비 약 67배 적은 부피의 샘플로 얻은 결과이다. □ 연구팀은 엑소좀 내 마이크로RNA가 질병 특이도 높은 바이오마커로서 쓰일 수 있기 때문에 이번에 개발한 체액 분석 기술을 활용하여 전립선암 외에도 다양한 질병을 보다 정확하고 민감하게 진단할 수 있을 것으로 기대하고 있다. □ 최낙원 박사는 “이번 연구에서 전립선암 환자 19명, 정상인 19명의 소변 내 엑소좀 마이크로RNA를 검출하였는데, 앞으로 코호트 규모를 확장시켜 보다 확실한 전립선암 확진 마커를 발굴해낼 수 있을 것”이라고 밝혔다. □ 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업, 나노소재기술개발사업, 선도연구센터 등의 지원으로 수행된 이번 연구의 성과는 바이오센서 분야 국제학술지 바이오센서스 & 바이오일렉트로닉스(Biosensors & Bioelectronics)에 7월 16일 온라인 게재되었다. 본 저작물은 한국연구재단에서 2021년 작성한 보도자료를 이용하였으며, 해당 저작물은 한국연구재단(https://www.nrf.re.kr/cms/board/subject/view?menu_no=95&page=&nts_no=161794&search_type=NTS_TITLE&search_keyword=&nts_type=)에서 무료로 다운받으실 수 있습니다.
- 46
- 작성자뇌과학연구소 최낙원·강지윤 박사팀
- 작성일2021.08.17
- 조회수68665
-
45

초소형 다기능 브레인칩, 뇌의 활동을 다각도로 분석
- 기존 상용 칩 1/8크기의 초소형 칩으로 신경전달물질 분석 - 약물주입, 뇌척수액 추출, 뇌신호 측정을 동시에...치료제 개발에 기여할 것으로 기대 뇌에 존재하는 여러 종류의 신경전달물질은 신경세포들간의 신호전달 과정에서 핵심적인 역할을 한다. 신경전달물질의 농도가 정상보다 높거나 낮으면 다양한 뇌질환을 유발하며, 이를 치료하기 위해 신경전달물질을 투여하기도 한다. 따라서 뇌질환의 원인규명이나 치료과정에서는 신경전달물질 농도의 정확한 측정이 중요하다. 그동안 뇌 속 신경전달물질의 농도를 측정하기 위해서는 0.5mm 크기의 뇌척수액 추출용 유체관을 삽입해야 했다. 이는 뇌 조직의 손상을 유발할 수 있을 뿐만 아니라, 유체관이 뇌의 여러 부위에 걸쳐 있게 되어 특정 뇌 부위에서의 신경전달물질 분석이 어려웠다. 또한 뇌가 정상적으로 활동하는지 판단하는 주요한 지표인 뇌 신호를 측정할 수 없어서 신경전달물질과 뇌활동과의 상관관계 분석이 어려웠다. 한국과학기술연구원(KIST, 원장 윤석진) 뇌과학연구소 조일주 단장 연구팀은 이러한 한계점을 극복하기위해 뇌척수액 추출용 유체 채널, 약물 주입용 유체 채널, 뇌 신호 측정용 전극이 집적된 초소형 다기능 브레인 칩을 개발했다고 밝혔다. 연구진은 앞서 2019년 세계 최초로 약물주입, 신호측정이 동시에 가능한 브레인칩을 개발해 국제학술지에 게재한 바 있다. 연구진은 뇌의 활동을 분석하는데에는 뇌에서 나오는 전기적 신호뿐만 아니라 뇌척수액의 분석이 중요한 도구인 점에 착안해 브레인 칩에 뇌척수액 추출용 유체관을 추가로 집적했다. 개발한 칩은 기존의 상용 뇌척수액 추출 기기보다 1/8배 작은 크기로 삽입과정에서 뇌조직의 손상을 최소화하고, 신경전달물질과 뇌 신호를 동시에 관찰해 뇌 활동 정밀 분석을 가능하게 했다. 또한 작은 유체관을 통해 낮은 압력으로 뇌척수액을 추출하기 때문에 장기간 사용시에 채널이 막히는 현상을 최소화 할 수 있었다. 연구팀은 개발된 다기능 브레인 칩을 살아 있는 생쥐 뇌에 삽입하여 뇌척수액을 추출함과 동시에 뇌 신호를 측정했다. 또한 신경 활동을 조절하는 약물을 생쥐에게 투약한 후 시간별로 신경전달물질과 뇌 신호 변화를 측정해, 뇌질환 치료약물의 효과를 다각도로 검증하는 실험을 수행했다. 그 결과 개발된 브레인칩이 뇌질환 치료제의 검증을 위한 새로운 도구로 사용할 수 있음을 확인했다. KIST 조일주 단장은 “새로운 신경전달물질 측정용 브레인 칩은 크기가 작으면서도 다양한 기능을 한번에 구현할 수 있어 뇌손상을 최소화하고 뇌질환 원인 및 치료제 등을 연구하는데 유용한 도구가 될 것이다. 우리가 개발한 시스템이 다양한 뇌 질환 모델 동물에 적용되어 효과적인 뇌 질환 치료제를 개발하는 데에 기여 할 것으로 기대된다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 한국연구재단의 뇌과학원천기술개발사업과 KIST 주요사업으로 수행되었으며, 이번 연구 결과는 ‘Biosensors and Bioelectronics’ (IF: 10.258, JCR 분야 상위 0.580%) 최신 호에 게재되었다. * (논문명) Bimodal neural probe for highly co-localized chemical and electrical monitoring of neural activities in vivo - (제1 저자) 한국과학기술연구원 채의규 학생연구원 - (교신저자) 한국과학기술연구원 조일주 책임연구원 그림 설명 [그림 1] 개발된 브레인 칩의 전자현미경 사진 [그림 2] 유체 및 전기인터페이스가 패키징된 브레인 칩 [그림 3] 생쥐 뇌에서 신경 활동을 자극하는 약물 주입으로 인한 뇌 신호 및 신경전달물질들의 변화를 관찰
- 44
- 작성자뇌과학연구소 조일주 박사팀
- 작성일2021.08.17
- 조회수53121
-
43
헌팅턴병 환자의 뇌조직에서 세포 손상 원리 발견
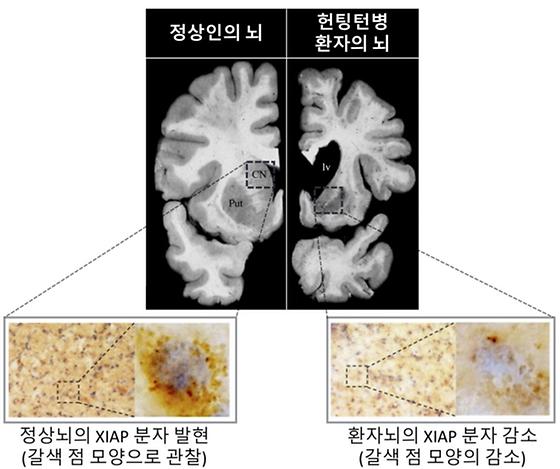
신경세포 내 미토콘드리아 기능 이상에 의한 질병 발생 원리 규명 헌팅턴병의 새로운 진단 및 치료 전략 수립 가능 퇴행성 뇌질환의 일종인 헌팅턴병은 상염색체 우성으로 유전되며 3~40세 전후로 발병해 15년 이내에 사망에 이르는 비극적 질환이며 치료방법이 없다. 성격변화, 치매와 함께 특징적 몸의 움직임(무도증)을 동반하는 희귀질환으로 국내에도 2천여 명의 환자가 있다. 돌연변이 헌팅틴 (Huntingtin) 유전자에 의해서 만들어지는 헌팅틴 단백질은 뇌 부위 중 선조체의 신경세포를 파괴해 스스로 통제 또는 조절하기 어려운 팔과 다리의 움직임을 나타낸다고 알려져 있지만, 헌팅턴 단백질이 선조체 신경세포를 손상시키는 정확한 기전은 밝혀지지 않았다. 한국과학기술연구원(KIST, 원장 윤석진)은 헌팅턴병 환자 뇌 조직에서 나타나는 병리현상을 연구해 신경세포가 손상되는 기전을 발견했다고 밝혔다. 본 연구는 실험동물과 세포모델을 기반으로 한 기존 연구들과 다르게 환자 뇌조직에서 나타나는 병리현상을 재조명하는 연구성과로서 헌팅턴 병의 새로운 치료전략에 도움이 될 것으로 기대하고 있다. KIST 뇌과학연구소 류훈 책임연구원, 보스턴대학교 의과대학 이정희 교수, 한양대학교 분자생명과학과 서혜명 교수팀으로 구성된 공동 연구진은 헌팅턴병 환자의 뇌조직, 마우스, 세포모델 실험을 통해 신경세포 사멸을 억제하는 XIAP 단백질이 정상적으로 발현되지 않게 되면서 미토콘드리아의 기능에 문제가 생기는 현상을 발견했다. 정상적인 상태에서 XIAP 단백질은 세포사멸에 관여하는 p53 분자를 자가포식작용으로 분해해 세포손상을 줄인다. 그런데, 헌팅턴병에 걸리면 XIAP 단백질의 발현 감소로 p53 분자의 분해가 줄어들고 활성이 증가해 비정상적인 세포손상이 일어나는 것을 발견했다. 공동연구팀은 이로 인해 증가한 p53 분자가 신경세포의 미토콘드리아로 이동해 세포손상에 발동을 거는 현상을 확인함으로써 지금까지 설명하기 어려웠던 헌팅턴병의 신경세포 손상기전과 치료를 위한 병리기전에 대한 상세한 정보를 얻을 수 있었다. 본 연구에 참여한 KIST 현승재 박사는 “헌팅턴병에서는 XIAP분자의 기능저하, p53 분자 활성으로 신경세포 손상이 일어나는데, 이 기전을 조절해 헌팅턴병의 새로운 치료전략을 제시할 수 있게 되었다.”고 연구결과의 의의를 설명했다. KIST 류훈 책임연구원은 “이번 연구성과는 마우스 모델이 아니라 헌팅턴 환자의 뇌 조직에서 발견한 새로운 병리기전이기 때문에 질병의 원인 파악과 치료에 한층 가깝게 다가갈 수 있을 것”이라며, “헌팅턴병 뿐만 아니라 치매 또는 파킨슨병과 같은 다른 퇴행성 뇌질환들의 병리기전을 이해하는 데도 도움이 될 것으로 기대한다.”고 말했다. 본 연구는 과학기술정보통신부(장관 임혜숙)의 뇌질환극복사업과 KIST 주요사업으로 수행되었으며, 연구결과는 국제 학술지인 ‘Progress in Neurobiology [IF : 11.685, JCR : 5.3% ]’ 최신호에 게재됐다. * (논문명) Dysfunction of X-linked inhibitor of apoptosis protein (XIAP) triggers neuropathological processes via altered p53 activity in Huntington‘s disease - (제 1저자) 한국과학기술연구원 현승재 박사후연구원 - (교신저자) 한양대학교 분자생명과학과 서혜명 교수 - (교신저자) 보스턴대학교 의과대학 이정희 교수 - (교신저자) 한국과학기술연구원 류훈 책임연구원 그림설명 [그림 1] 정상인의 뇌와 헌팅턴병 환자의 뇌에서 XIAP 분자의 발현 정도가 뚜렷하게 차이가 남을 보여줌 (XIAP 분자를 면역조직화학법으로 염색해 갈색으로 관찰 할 수 있게 처리. 헌팅턴 환자의 뇌에서 XIAP분자의 발현이 낮음을 확인) [그림 2] XIAP 분자에 의한 p53 단백질의 분해 촉진과정을 보여주는 그림. XIAP 분자가 감소하면 p53 분자가 분해되지 않고 양이 증가하여 신경세포 손상을 일으킴.
- 42
- 작성자뇌과학연구소 류훈 박사팀
- 작성일2021.08.04
- 조회수37385
-
41
인체 세포막 특성 모사해 바이오센서 민감도 획기적 개선
- 세포막의 이온농도 조절 특성을 통해 바이오센서 검지능력 향상 - 의료·방역·환경 감시까지 폭 넓은 확장성 국내 연구진이 세포막을 이용해 민감도를 획기적으로 개선한 바이오센서 원천기술을 개발하는 데 성공했다. 한국과학기술연구원(KIST, 원장 윤석진)은 뇌과학연구소 유용상 박사, 센서시스템연구센터 김철기 박사팀이 고려대학교(고려대, 총장 정진택) 화공생명공학과 안동준 교수팀과의 공동연구를 통해 ‘전기신호를 이용하는 분자 검출기술(FET, 전계효과 트랜지스터)’의 민감도를 획기적으로 끌어 올리는 기술을 개발했다고 밝혔다. 전기신호를 이용하는 센서 기술인 FET 기반 분자검출 기술은 그간 바이러스, 단백질, DNA 등 다양한 분자를 검출할 수 있다는 장점에도 불구하고 상용화가 쉽지 않았다. 검출물의 용액 내에 존재하는 이온 및 전하의 농도가 높을수록 분자 검출 가능 영역이 얇아지기 때문이다. 예를 들어 혈액 한 방울의 경우 분자 검출 가능 영역은 검출하려는 분자보다도 얇은 1나노미터(nm) 수준에 불과해 분자가 검출부에 부착되었더라도 전기신호 관측이 어려웠다. 이에 따라 학계에서는 혈액 등의 검사 대상 용액을 최대 10만 배까지 희석하는 등 다양한 전략을 통해 분자검출 능력을 높이기 위해 애썼지만 별다른 성과를 거두지 못하고 있었다. 연구팀은 이 같은 걸림돌을 제거할 아이디어를 사람의 세포막에서 얻었다. 인체의 세포막은 세포 안팎의 이온 농도를 조절할 뿐만 아니라 고농도 이온이 세포 내부로 침투하는 것을 억제한다. 연구팀은 세포막의 이 같은 특성에 주목했다. 기존의 FET 기반 분자검출 칩 표면에 세포막을 도포하는 실험을 거듭한 끝에 고농도 이온 용액에서도 별도의 전처리 없이 분자검출이 가능하다는 것을 확인했다. ‘세포막-FET(Lipid-FET)’로 명명된 새로운 기술은 기존처럼 검사 대상 용액을 10만 배 이상 희석하지 않고 혈액 원액 그대로도 기존 센서보다 민감하게 원하는 분자를 검출할 수 있다. 이는 현재까지 전 세계적으로 보고된 전계효과 기반 분자검출기술 중 가장 뛰어난 성능을 나타내고 있는 것으로 확인됐다. 이번 연구성과와 관련해 더욱 주목할 만한 부분은 해당 기술이 치매 단백질 등 다양한 질환을 진단할 수 있을 뿐만 아니라 바이러스성 감염병과 미세 플라스틱 등 의료, 보건, 환경 등 바이오센서 전반에서 광범위하게 응용이 가능한 플랫폼 기술이란 점이다. KIST 유용상 박사는 “IT, NT, BT 등 여러 분야의 공동연구진이 융합연구를 통해 개발한 세포막-FET 분자검출 기술은 현재 전기적 신호를 이용해 분자를 검출하는 모든 시스템에 바로 적용할 수 있는 기술”이라고 말했으며, KIST 김철기 박사는 “세포막에 흡착돼 단백질 변성을 일으킨다고 알려진 치매, 파킨슨병, 당뇨병 등과 같은 질병뿐만 아니라 코로나19, 조류독감 등 극미량의 감염병 바이러스를 더욱 신속하고 정밀하게 진단하는 기술 등 다양한 연구분야에 폭넓게 적용될 수 있게 하는 연구를 병행하고 있다.”라고 밝혔다. 고려대 안동준 교수는 “본 기술을 확장하여 다양한 사회 문제 해결과 인류의 삶의 질 향상에 전반적으로 기여할 수 있게 되기를 바란다.”라고 말했다. 이번 연구는 과학기술정보통신부(장관 임혜숙)의 지원을 받아 KIST 주요사업, KU-KIST 사업 및 한국연구재단 중견연구자지원사업 및 미래소재디스커버리사업으로 수행되었으며, 연구 결과는 융합기술 분야 권위지인 ‘Nature Communications’ (IF: 14.919, JCR 분야 상위 4.795%) 최신 호에 게재되었다. * (논문명) Ionic contrast across a lipid membrane for Debye length extension: towards an ultimate bioelectronic transducer - (제 1저자) 한국과학기술연구원 이동근 학생연구원 - (제 1저자) 고려대학교 화공생명공학과 정우혁 - (교신저자) 고려대학교 화공생명공학과, KU-KIST융합대학원 안동준 교수 - (교신저자) 한국과학기술연구원 유용상 선임연구원 - (교신저자) 한국과학기술연구원 김철기 책임연구원 <그림 설명> [그림 1] KIST, 고려대 공동연구진이 개발한 세포막-전계효과트랜지스터의 분자 검출에 대한 모식도 [그림 2] KIST, 고려대 공동연구진이 개발한 세포막-전계효과트랜지스터 바이오센서
- 40
- 작성자뇌과학연구소 유용상 박사·센서시스템연구센터 김철기 박사팀
- 작성일2021.07.29
- 조회수43590
-
39
인체 삽입형 의료기기 코팅기술 개발, 의료기기 수명연장과 안정성을 동시에 확보
- 윤활 코팅으로 기기 삽입시 브레인 조직의 손상과 염증반응을 최소화 - 인체 삽입형 기기의 수명을 4배 이상 늘려 상용화 앞당길 것으로 기대 최근 뇌에 브레인칩을 삽입하여 생각만으로 기계를 움직이는 뇌-기계 인터페이스 기술을 비롯해 파킨슨 병 등 뇌질환 치료를 위한 뇌심부 자극기 등 다양한 인체 삽입형 의료기기들이 개발되어 의료 현장에서 활용되고 있다. 하지만, 인체에 삽입되는 기기는 주위 생체조직에 면역반응을 유도하고, 이로 인한 기기의 성능 저하로 장기간 사용이 어렵다. 뇌심부 자극기나 브레인칩 역시 뇌에 삽입되면 미세아교세포 등 뇌면역세포의 작용으로 안정적인 동작이 저해되고, 기기 수명이 단축되어 교체를 위한 추가적인 수술이 필요하다. 한국과학기술연구원(KIST, 원장 윤석진)은 뇌과학연구소 조일주 단장 연구팀이 연세대학교 (연세대, 총장 서승환) 서정목 교수 연구팀과의 공동연구를 통해 뇌를 포함, 인체에 삽입되는 의료기기 코팅기술을 개발했으며 이를 통해 삽입과정의 조직손상을 최소화하고 염증반응을 억제해 기기의 수명을 기존 기기 대비 4배 이상 향상시키는 성과를 거두었다고 밝혔다. 개발한 기술은 인체에 삽입되는 기기 표면에 단분자막과 윤활유를 얇고 균일하게 코팅하는 방법이다. 이는 기기가 인체에 삽입되는 동안 발생하는 기기-조직간의 마찰을 감소시켜 조직 손상을 최소화한다. 더불어 면역거부반응에 의해 활성화 된 면역세포들이 기기 표면에 붙는 것을 막는 면역세포 부착 방지 특성을 나타낸다. 연구팀은 실험을 통해 생쥐 뇌에 개발한 코팅 기술이 적용된 신경 탐침을 삽입해 관찰한 결과 삽입직후 신경 탐침 내 32개의 뇌신호 측정 전극 중 90% 이상의 전극에서 뇌신호가 성공적으로 관찰할 수 있었다. 이는 코팅기술이 적용되지 않은 신경탐침에서 관찰되는 신호의 2배이며, 뇌조직의 관찰을 통해서도 삽입 과정에서 발생하는 조직손상을 최소화했음을 확인했다. 안정성 면에서도 코팅막 처리가 되지않은 탐침의 경우 면역세포들이 기기표면에 붙어 시간이 지남에 따라 신호측정 기능이 떨어졌으나 코팅기술이 적용된 탐침은 생물부착방지 특성으로 기존 전극에 비해 4배가 긴 4개월 간 안정적으로 뇌신호 측정이 가능했다. 조일주 단장과 서정목 교수는 “개발한 코팅 기술은 뇌 뿐아니라 다른 인체 부위 삽입 기기에도 활용이 가능하며, 관련 기기의 수명을 획기적으로 연장할 수 있을 것”이라며, “인체 삽입형 의료기기의 교체 주기를 획기적으로 늘려 빠른 상용화에도 기여 할 것으로 기대한다”라고 말했다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 한국연구재단의 신진연구자 지원사업과 뇌과학원천기술개발사업 등으로 수행되었으며, 이번 연구 결과는 ‘Advanced Science’ (IF: 16.80 JCR 분야 상위 5.255%) 에 표지논문으로 선정되었다. * (논문명) A Lubricated Nonimmunogenic Neural Probe for Acute Insertion Trauma Minimization and Long-Term Signal Recording - (제 1저자) 연세대학교 이연택 학생연구원 - (제 1저자) 한국과학기술연구원 신효근 박사후연구원 - (교신저자) 한국과학기술연구원 조일주 책임연구원 - (교신저자) 연세대학교 서정목 교수 <그림 설명> [그림 1] 코팅이 적용되지 않은 신경 탐침(위)과 적용된 신경 탐침(아래)간에 뇌조직과의 마찰 특성 및 생물 부착 특성 비교에 관한 개략도 (코팅이 적용된 신경탐침(아래)의 경우 대조군(위) 대비 미세아교세포 등 뇌면역세포의 활성과 세포부착이 현저히 적음을 확인) [그림 2] 코팅이 적용된 신경 탐침의 분해도 및 코팅 적용 과정에 관한 모식도 [그림 3] 코팅 적용에 따른 실리콘산화물과 백금흑 표면에서의 접촉각 및 생물 부착 특성 (실리콘산화물, 백금흑 모두 코팅이 적용된 표면은 대조군 대비 소수성 특징을 보임) [그림 4] 코팅이 적용되지 않은 신경 탐침과 적용된 신경 탐침간의 뇌조직 손상 비교 및 탐침 주변 뇌면역세포 활성도 비교 (코팅이 적용된 탐침의 경우 조직손상과 뇌면역세포의 활성이 적음) [그림 5] 코팅이 적용되지 않은 신경 탐침과 적용된 신경 탐침을 통해 측정된 대표적인 뇌신경 신호 (삽입 후 1일, 삽입 후 8주 뒤, 신호 측정 결과) (코팅이 적용된 신경탐침의 경우 8주 후에도 안정적으로 작동함을 확인)
- 38
- 작성자뇌과학연구소 조일주 박사팀
- 작성일2021.07.11
- 조회수21282
-
37
KIST-KRIBB, 치매 원인물질 분해하는 신규 메커니즘 규명
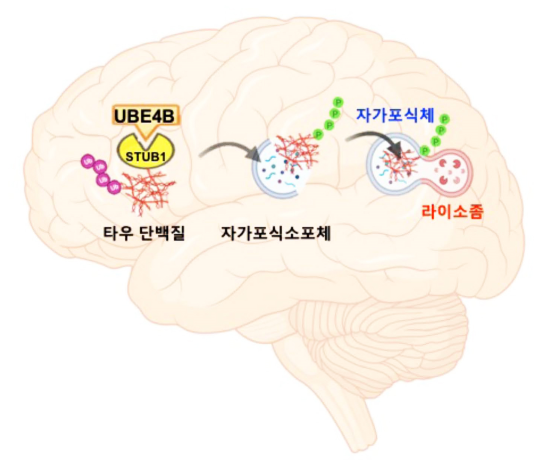
- 치매 주요 발생인자 ‘타우단백질’의 자가포식 분해 원리 규명 건강보험심사평가원의ㆍ 치매 진료현황 분석에 따르면 우리나라의 치매환자 증가율은 연평균 16%로 65세 이상 노인 10명 중 1명이 치매를 앓고 있다. 또한 60세 미만에서도 환자 수가 꾸준히 늘고 있어 치매 예방과 치료에 대한 대책 마련이 시급한 상황이다. 이런 가운데 국내 연구진이 새로운 형태의 치매 원인 제거 원리를 찾아냈다. 한국과학기술연구원(KIST, 원장 윤석진)은 치매의 유력한 발생인자로 지목되고 있는 ‘타우단백질’을 자가포식으로 분해하는 원리를 발견했다고 밝혔다. 기존의 연구들은 대부분 단백질 분해효소인 프로테아좀을 이용해 타우단백질 제거를 유도하고 있지만 아직까지 뚜렷한 성과를 거두지 못하고 있다. 따라서 자가포식을 이용한 타우단백질 분해 원리의 규명이 기존의 치매 치료 전략에도 큰 변화를 불러일으키게 될 것으로 전망된다. 그간 뇌신경세포 속 타우단백질의 비정상적인 응집은 치매의 주요 발생 원인으로 거론되어왔다. 타우단백질이 잘못 엉키면서 신경세포를 파괴해 인지 기능과 기억력 상실을 일으키는 것으로 알려져 있다. 하지만 타우단백질이 신경세포에서 응집되고 분해되는 정확한 과정에 대해서는 현재까지 밝혀진 바가 없었다. KIST 뇌과학연구소 류훈 박사팀과 한국생명공학연구원(KRIBB, 원장 김장성) 질환표적구조연구센터 유권 박사팀, 이화여자대학교 송은주 교수팀으로 구성된 공동연구진은 치매 초파리와 마우스 모델 실험에서 mRNA 유전자를 조작해 UBE4B 단백질의 발현을 증가시키면 타우단백질의 비정상적인 응집이 감소하며 치매 실험동물의 행동이 향상되는 현상을 확인했다. UBE4B의 증가가 타우단백질의 분해를 촉진하고 있음을 발견한 것이다. 이를 통해 연구진은 좀처럼 설명하기 어려웠던 세포의 타우단백질 분해 메커니즘에 대해 보다 상세한 지식을 얻게 됐다. 기존에 알려져 있던 프로테아좀보다 자가포식 작용이 타우단백질 제거에 더 효과적이란 사실이다. 연구진은 자가포식을 유도하는 UBE4B를 타깃으로 치매 진단과 치료제 개발 가능성이 높아짐에 따라 새로운 타우단백질 분해 조절 인자에 대해 특허 출원을 진행 중이다. KIST 류훈 박사는 “타우단백질 분자가 자가포식작용(오토파지)에 의해 분해되는 과정을 규명해 치매 병리현상 예방과 개선의 새로운 길을 확인했다는 데 큰 의미가 있다”고 연구 의의를 밝혔다. 또한 KRIBB 유권 박사는 “초파리 치매 모델에서 발견한 새로운 타우단백질 분해 기전이 마우스 치매 모델에서도 확인된 연구로 새로운 치매 대응 전략을 제시하게 될 것”이라고 말했다. 본 연구는 과학기술정보통신부(장관 임혜숙)의 지원을 받아 KIST 주요사업으로 수행되었으며, 연구결과는 국제 학술지인 ‘Nature Communications’ (IF 12.121) 최신호에 게재됐다. * (논문명) UBE4B, a microRNA-9 target gene, promotes autophagy-mediated Tau degradation - (제 1저자) 한국생명공학연구원 Manivannan Subramanian 박사후연구원 - (제 1저자) 한국과학기술연구원 현승재 박사후연구원 - (교신저자) 이화여자대학교 송은주 교수 - (교신저자) 한국과학기술연구원 류훈 책임연구원 - (교신저자) 한국생명공학연구원 유권 책임연구원 <그림설명> [그림 1] 치매를 일으키는 타우단백질이 UBE4B와 STUB1 분자의 작용에 의해 자가포식체를 경유하여 분해되는 과정 [그림 2] 초파리 눈에서 UBE4B에 의한 타우단백질의 독성완화 관찰, UBE4B 유전자가 타우단백질에 의한 초파리 눈의 손상을 회복시킴
- 36
- 작성자뇌과학연구소 류훈 박사팀
- 작성일2021.06.27
- 조회수28045
-
35
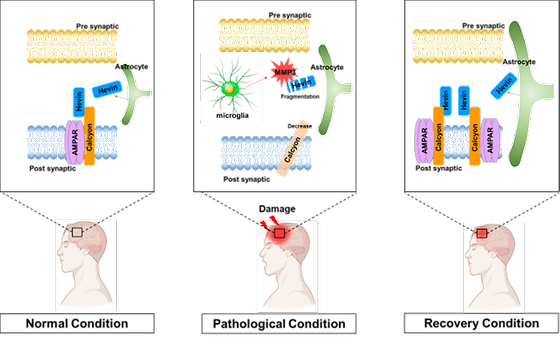
뇌 손상 회복하는 새로운 단백질 결합 발견
- 뇌 손상시 나타나는 염증반응에 의해 유도된 효소가 뇌 손상 회복 방해 - 성인 뇌 신경세포가 복구되기 위해서는 새로운 단백질 결합(Hevin-Calcyon) 필요 뇌졸중, 외상 등에 의해 뇌가 손상된 환자는 현재로서는 확실한 치료법이 없어 재활치료에 집중하고 있는 것이 현실이다. 특히 성인의 경우에는 어린아이들보다 뇌 손상의 회복 속도가 매우 더디거나 불가능한 것으로 알려져 있는데, 학계에서는 성인의 뇌에는 뇌 기능을 복구할 수 있는 여분의 신경줄기세포가 어린아이보다 부족하기 때문이라고 생각해왔다. 국내 연구진이 뇌 손상 회복에 관련한 새로운 기전을 밝히고, 동물모델 실험에서 실제로 단백질 양의 조절을 통해 뇌 손상 회복 기간을 단축시킬 수 있다는 사실을 규명하여 화제다. 한국과학기술연구원(KIST, 원장 윤석진)은 뇌과학연구소 황은미 박사팀이 경북대학교 의과대학 석경호 교수팀과의 공동연구를 통해 성인의 뇌 손상이 복구되는 과정에 새로운 단백질 간의 결합(Hevin-Calcyon)이 필요하며, 이 결합은 회복의 초기 단계에서 중요하게 작용한다는 것을 새롭게 확인했다고 밝혔다. KIST 연구진은 오랜 시간 특징이 알려지지 않았던 뇌의 신경교세포에서 분비되는 단백질인 헤빈(Hevin)과 반응하는 칼시온(Calcyon) 단백질과의 결합을 발견하였고, 이러한 결합이 신경세포의 회복과정에 매우 중요한 역할을 한다는 것을 과학적으로 증명하였다. 신경세포는 일반적으로 뇌의 기능적 측면에 직접적으로 관여한다고 알려진 세포로, 신경세포가 회복되어야 뇌질환이 치료된다고 볼 수 있다. 연구팀은 뇌 속의 헤빈-칼시온 결합을 증가시키면 뇌 안에서 신경세포 간에 더 많은 연결부위를 빠르게 생성하게 하여 손상된 뇌 기능이 조기에 회복된다는 것을 확인했다. 두 단백질은 정상적인 뇌 조직에서는 결합된 형태의 단백질들이 잘 관찰되나, 외상성 뇌 손상을 받은 환자에게서는 결합 단백질의 양이 현저히 감소하여 있음을 확인하였다. 경북대 연구진은 뇌 손상 동물모델을 결합된 단백질을 통해 이용하여 뇌 손상이 회복되는 과정을 단계적으로 확인하였다. 연구진은 뇌 손상 초기에 진행되는 염증반응으로 인해 유발된 효소단백질이 헤빈을 분해하여 헤빈-칼시온 결합을 저해한다는 것을 발견하였다. 4주 정도면 회복되는 뇌 손상을 입은 동물 실험에서 뇌의 손상 부위에 직접 염증반응 억제제를 투여하면 2~3주 만에 회복될 만큼 빨라졌고, 반대로 염증 단백질을 추가로 투여하면 회복이 더뎌짐을 확인하였다. 공동연구팀은 뇌 손상 회복에 중요한 초기 단계에 과정에 헤빈-칼시온 결합이 부족하게 되면 효과적인 복구과정이 저해될 가능성이 있다는 사실을 밝혀냈다. 이 연구는 새로운 단백질간 결합을 발견한 KIST 황은미 박사팀과 인간 외상성 뇌 손상을 연구해온 KIST 류훈 박사팀 그리고 다양한 동물모델에서의 염증 연구를 수행해온 경북대 석경호 교수팀이 각자의 전문분야를 살린 5년간의 지속적인 융합연구 결과이다. KIST 황은미 박사는 “뇌 손상뿐만 아니라 퇴행성 뇌 질환에서도 공통적으로 염증반응이 나타나므로, 이러한 뇌 질환들을 치료하기 위해서는 헤빈-칼시온 결합을 고려해야 함을 알 수 있다.”이라며, “본 연구 결과는 향후 시냅스 형성장애와 관련된 난치성 뇌 질환 치료제 개발로 이어질 수 있을 것”이라고 밝혔다. 이 연구는 과학기술정보통신부(장관 최기영)의 지원으로 한국연구재단 뇌원천기술개발사업으로 수행되었으며, 연구결과는 국제 학술지인 「Cell Death & Differentiation」 (IF : 10.717, JCR 분야 상위 6.229%) 최신호에 게재되었다. * (논문명) Hevin?calcyon interaction promotes synaptic reorganization after brain injury - (제 1저자) 경북대학교 의과대학 김종헌 연구교수 - (제 1저자) 한국과학기술연구원 정현국 연구원 - (교신저자) 한국과학기술연구원 황은미 책임연구원 - (교신저자) 경북대학교 의과대학 석경호 교수 <그림 설명> [그림 1] 헤빈-칼시온 결합에 염증 활성효소의 작용 매커니즘 [그림 2] 만성 외상성 뇌병증(CTE) 환자 뇌에서 헤빈-칼시온 결합(붉은 점)의 감소
- 34
- 작성자뇌과학융합연구단 황은미 박사팀
- 작성일2021.04.08
- 조회수31509
-
33
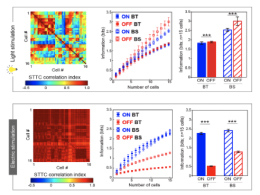
생생한 시각 정보 전달, 다양한 신경 신호가 핵심!
- 신호의 다양성을 낮추면 극심한 신경 정보 손실 발생 - 자극 방법 최적화로 다양성을 높이면 풍부한 시각 정보 표현할 인공 시각 구현 우리가 사물을 시각적으로 인지하는 것은 안구의 신경 조직인 망막에서 시작된다. 망막에서는 1억 개가 넘는 광수용체 세포가 빛을 검출하고, 1백만 개가 넘는 시신경 세포가 신경 신호를 압축하여 뇌로 전달하여 시각을 형성한다. 시력을 잃어가고 있는 배우 송승환씨 등을 통해 알려진 망막 색소 변성 및 노인성 황반 변성 등의 질환에서는 살아남은 망막 신경 세포들을 전기적으로 자극하는 인공 망막 장치가 유일한 시력 회복 방법이다. 하지만, 정상 시각 대비 현저히 떨어지는 인공 시각의 품질을 획기적으로 개선하는 것이 큰 과제로 남아 있다. 한국과학기술연구원(KIST, 원장 윤석진) 뇌과학연구소 임매순 박사팀은 서로 다른 시신경 세포의 높은 신호 다양성이 고효율 시각 정보 전달을 위한 핵심 요소임을 확인했다고 밝혔다. 인공 시각 분야에서 응용 가능성이 클 것으로 전망된다. KIST 연구진은 토끼 망막 신경 세포에서 얻어진 신경 신호에 계산신경과학 및 정보이론을 적용하여 시각 정보 전달을 정량화하였다. 특히, 신경 신호의 여러 특징 중 다양성을 주목한 연구팀은 서로 다른 세포들 간의 정보 패턴의 다양성이 높을수록 정보량이 증가하는 것을 확인하였다. 그와 동시에 정보 전달 과정에서 오류를 방지하기 위해 다양성을 일정 수준 낮추고 어느 정도의 중복성을 허용한다는 사실도 확인하였다. KIST 연구진은 전기 자극 실험을 통해 정상 망막과 인공 망막 장치의 시각 정보 전달 방식을 비교한 결과, 놀랍게도 임상 시험에서 인공 망막 사용자들이 보다 쉽게 인지하는 반응에 관여한 세포들이 더 높은 신경 신호 다양성을 보여주었다. 반면에 임상 시험에서 잘 인지되지 않던 반응을 담당하는 세포들은 정상적인 빛 자극에서 보였던 세포 간 신호의 다양성이 사라지고, 전기 자극에 대해 매우 균일한 신경 신호를 생성하였다. 이러한 신경 신호 다양성 상실은 전달되는 시각 정보의 극심한 감소로 이어졌으며, 정보 부족으로 인해 인공 망막 장치 사용자의 뇌에서 해석하기 어려운 것으로 이해된다. 한편, 임매순 박사는 망막 변성이 진행된 생쥐들을 연구한 결과, 각 시신경 세포가 전달하는 신호의 일관성이 안정적인 시각 인지에 중요한 요소임을 밝힌 바 있다.(※IEEE TNSRE, vol. 28, no. 9, pp. 1921-1930, Sept. 2020) KIST 강준호 박사는 “신경 세포들을 단순히 자극하는 것만으로는 매우 복잡한 시각 정보를 성공적으로 구현하기 어렵다는 것을 의미한다. 서로 다른 세포들이 각기 다른 신경 신호를 만들면 고품질 인공 시각 구현이 가능할 것으로 보인다.”라고 말했으며, 임매순 박사는 “작년 연구 내용과 종합하면, 서로 다른 시신경 세포들이 다양한 신경 신호를 일관되게 전달해야 우리의 머릿속에서 생생한 시각 정보를 안정적으로 인지하게 되는 것으로 보인다.”라며, “본 연구를 통해 인공 시각 뿐 아니라 다양한 분야에서 뇌 기능을 제어하기 위해서는 단순히 신경 신호를 형성하는 것에 머무르지 않고 복잡한 신경 네트워크의 신호 다양성을 모사할 수 있도록 노력해야 한다는 것을 알게 됐다.”라고 연구 의의를 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업과 한국연구재단 신진연구자지원사업으로 수행되었으며, 연구 결과는 ‘IEEE Transactions on Neural Systems and Rehabilitation Engineering’ 최신호에 게재되었다. * (논문명) Electric stimulation elicits heterogeneous responses in ON but not OFF retinal ganglion cells to transmit rich neural information - (제 1저자) 한국과학기술연구원 강준호 위촉연구원 - (교신저자) 한국과학기술연구원 임매순 선임연구원 <그림설명> [그림 1] 망막 신경 신호 다양성과 뇌의 시각 피질 활성화 개념도 단조로운 (다양성 낮은 균일한) 신경신호는 전달할 수 있는 정보가 제한적이기에 시각 피질의 활성화가 적은 반면, 다양한 신경 신호는 보다 많은 정보를 전달하여 시각 피질의 활성화를 증가시킴 [그림 2] 빛 자극(위)과 전기 자극(아래) 후 신경 신호 일관성 변화 및 정보 전달 분석결과 - 동일 빛 또는 전기 자극에 대해 서로 다른 신경 세포의 신경 신호의 서로 비슷한 정도(Correlation) STTC(Spike Time Tiling Coefficient) 값을 계산하여 비교 분석함 - STTC 값 그래프에서는 붉은색이 많을수록 신경 신호 다양성이 낮고, 알록달록해질수록 다양성이 높아짐을 의미함. - 각 세포 종류별로 각각 빛과 전기 자극 인가 후 발생한 신경 신호에서 전달되는 시각 정보의 총량을 계산하여, 밝은 것을 표현하는 ON 세포의 경우 전기 자극에 의해서도 빛 자극과 비슷한 신경 신호 다양성을 유지하지만, 어두운 것을 표현하는 OFF 세포의 경우 전기 자극으로 발생하는 신경 신호의 다양성이 현저하게 낮아 전달되는 시각 정보 손실이 큰 것을 확인함. 이는 임상 시험에서 어두운 것보다 밝은 것을 잘 인지했던 것을 설명함
- 32
- 작성자뇌과학연구소 임매순 박사팀
- 작성일2021.02.01
- 조회수31611
-
31
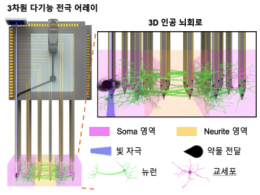
인공 뇌 신호 분석해서 뇌 지도 제작한다
- 평면형태의 뇌 신호만 측정할 수 있던 기술의 한계 극복 - 인간 세포 기반 인공 뇌에 적용 가능한 새로운 뇌 질환 치료제 평가 방법 제시 우리 뇌는 다른 장기와는 달리 두껍고 단단한 두개골로 덮여 있어 접근이 어려워 해상도가 낮은 영상 기반이나 두개골 밖에서 측정하는 뇌파 분석 등으로 연구 방법이 한정되어 있었다. 이로 인해 뇌의 발달 단계에서 일어나는 다양한 현상이나 장애의 원인, 그리고 그 치료기술을 개발하는 연구에도 한계가 있었다. 최근에는 쥐에서 추출된 신경세포나 인간 유래의 유도만능줄기세포(iPSC)를 이용하여 인공 뇌를 구현하고, 이를 이용하여 뇌 발달 과정을 연구하거나 뇌 질환의 원인을 규명하는 연구가 뇌의 신비를 풀어 줄 열쇠로 주목을 받고 있다. 과거 인공 뇌는 평면 형태로 제작하여 연구해왔는데, 입체적인 실제 뇌와의 괴리를 줄이기 위해 3차원(3D) 형태의 입체적인 인공 뇌가 2017년 KIST 연구팀에 의해 개발된 바 있다. 하지만, 3D 인공 뇌의 신호를 연구하기 위한 분석 툴은 개발되지 않아, 표면에서의 신호만 분석하거나 입체 구조를 평면 형태로 무너뜨려 연구해야 해서 복잡하게 얽혀진 인공 신경망에서의 신경 신호 추적에 한계가 있었다. 한국과학기술연구원(KIST, 원장 윤석진)은 뇌과학연구소 조일주, 최낙원 박사팀이 입체 형태의 인공 뇌 회로를 망가뜨리지 않고 정밀하게 자극하고 세포 단위의 신경 신호를 내부의 여러 곳에서 실시간으로 측정할 수 있는 초소형 분석 시스템을 개발했다고 밝혔다. 연구진이 개발한 3차원 다기능 신경 신호 측정 시스템은 머리카락 절반 정도인 50㎛ 두께의 실리콘 탐침 어레이에 63개의 침 형태의 전극을 집적한 형태로, 인공 뇌에 꽂아 뇌 신경망 회로 내부 여러 곳의 신호를 동시에 측정할 수 있다. 탐침 내부에는 광섬유와 약물 전달 채널이 집적되어 있어 뇌 세포를 빛이나 약물로 정밀하게 자극하여 자극에 반응하는 인공 뇌 회로의 기능 변화를 측정함으로써, 인공 뇌를 이용한 뇌 기능 및 질환 연구를 가능하게 하였다. 연구팀은 개발된 시스템을 이용하여 인공 뇌의 뇌세포를 빛으로 자극하고 이에 반응하여 전파되는 신호를 여러 곳에서 동시에 측정하여 뇌 신호의 전파속도가 뇌세포 부위별로 다름을 밝혀내었다. 뇌지도를 작성함에 있어 전자현미경을 통해 제작할 수 있는 구조적 뇌 지도뿐만 아니라 복잡한 인공 뇌 회로망 내에서 뇌 회로가 어떻게 기능적으로 연결되어 있는지를 보여주는 3차원 기능적 뇌지도를 작성할 수 있는 가능성을 확인했다. KIST 최낙원 박사는 “개발한 시스템을 통해서 다양한 뇌 발달 장애와 뇌 질환의 원인 및 치료 방법 등을 연구할 수 있게 되었다.”라고 말했다. 공동 연구책임자인 조일주 박사는 “기존에는 불가능하였던 3차원의 인공 뇌 기능 측정을 가능하게 하는 시스템 개발로 다양한 뇌 질환 치료제 개발 기간을 획기적으로 단축할 수 있는 역할을 할 수 있을 것으로 기대된다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업과 한국연구재단의 미래뇌융합기술개발사업으로 수행되었으며, 이번 연구 결과는 ‘Nature Communications’ (IF: 12.121) 최신 호에 게재되었다. * (논문명) 3D high-density microelectrode array with optical stimulation and drug delivery for investigating neural circuit dynamics - (제 1저자) 한국과학기술연구원 신효근 학생연구원 - (교신저자) 한국과학기술연구원 최낙원 책임연구원 - (교신저자) 한국과학기술연구원 조일주 책임연구원 <그림설명> [그림 1] 3D 인공 뇌 회로와 자극 및 신경 신호 측정을 위한 3차원 다기능 전극 어레이 [그림 2] KIST 연구진이 제작한 3차원 인공 뇌 회로 측정용 다기능 3D 전극 어레이
- 30
- 작성자뇌과학연구소 조일주, 최낙원 박사팀
- 작성일2021.01.29
- 조회수15281