연구소 소개
-
59
새로운 세포 청소부, 뇌 속 별세포가 알츠하이머 치매 치료 가능성 높인다.
- 별세포의 자가포식 작용, 치매 원인 물질 제거 및 뇌 기능 회복 가능성 높여 - 비신경세포인 별세포를 새로운 알츠하이머 치매 치료제의 표적으로 제시 한국과학기술연구원(KIST, 원장 오상록) 뇌질환극복연구단 류훈 박사 연구팀은 기초과학연구원(IBS, 원장 노도영) 이창준 단장 연구팀, 보스톤 의대 이정희 교수 연구팀과 공동으로 별세포(Astrocyte)를 활용해 알츠하이머 치매 치료 메커니즘을 규명하고 새로운 치료 표적을 제시했다. 공동 연구진은 이번 연구를 통해 뇌 속 비신경세포인 별세포의 자가포식(Autophagy, 오토파지) 작용이 알츠하이머 치매 환자 뇌 속에서 아밀로이드 베타(Aβ) 올리고머 독성 단백질을 제거하고 기억력과 인지 능력을 회복하는 것을 밝혔다. 노인성 치매의 대표적인 사례로 알려진 알츠하이머 치매는 아밀로이드 베타(Aβ)와 같은 독성 단백질이 뇌 안에서 비정상적으로 응집 및 축적되면서 염증 반응과 신경세포의 손상을 유발해 나타나는 퇴행성 뇌 질환이다. 지금까지 학계에서는 별세포가 신경세포 주변의 독성 단백질을 제거하는 것에 주목했으나 그 과정은 명확히 규명되지 않았다. 오토파지란 세포 스스로(Auto)가 잡아먹는(Phagy) ‘자가포식’ 과정이다. 연구팀이 세포의 항상성을 유지하는 별세포의 자가포식 작용에 주목한 결과, 알츠하이머 환자의 뇌에서 독성 단백질 축적이나 뇌 염증 반응 발생 시 별세포가 자가포식 작용을 조절하는 유전자를 유도해 대응하고 있음을 관찰했다. 이를 바탕으로 별세포에만 선택적으로 발현하는 자가포식 유전자를 알츠하이머가 유도된 쥐의 뇌에 주입해 손상된 신경세포가 회복되는 과정을 확인했다. 연구팀은 별세포의 자가포식 작용이 아밀로이드 베타(Aβ) 단백질 덩어리를 줄이며 동시에 기억력과 인지 기능을 함께 개선할 수 있다는 사실을 입증했다. 특히, 뇌의 기억을 저장하는 해마 부위에서 자가포식 조절 유전자 발현이 증가할 경우, 뇌 조직 내 병리 현상이 줄어드는 사실도 확인했다. 무엇보다 알츠하이머 치매의 주원인으로 알려진 아밀로이드 베타(Aβ) 올리고머 독성 단백질 제거에 별세포의 자가포식 기능이 활용될 수 있음을 입증함으로써 알츠하이머 치매 치료의 가능성을 제시했다. 이번 연구는 알츠하이머 치료제 개발을 위해 진행된 신경세포 중심 접근법에서 벗어나 비신경세포인 별세포를 새로운 알츠하이머 치매 치료제의 표적으로 제시한 점에서 큰 의의를 지닌다. 연구진은 별세포의 자가포식 기능을 강화해 치매 증상을 예방하거나 완화할 수 있는 약물을 탐색하고 이에 대한 전임상 연구를 진행할 계획이라고 밝혔다. KIST 류훈 박사는 “별세포의 자가포식 기능에 따라서 신경세포의 손상이 조절되고 또한 치매 뇌에서는 인지 기능 또한 조절됨을 밝혔다”라며, “자가포식과 관련된 세포 생물학적 기전 이해를 증진하고 세포 내 노폐물 제거 및 세포 건강 유지에 관한 기초 연구의 발전을 기대한다”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 유상임)의 지원을 받아 KIST 주요사업 및 중견연구자지원사업(2022R1A2C3013138), 보건복지부(장관 조규홍)의 치매극복과제(RS-2023-KH137130)으로 수행됐다. 이번 연구 성과는 국제 학술지 「Molecular Neurodegeneration」 (IF 14.9, JCR 분야 2.1%)에 최신 호에 게재됐다. [그림 1] 별세포(성상 교세포)의 자가포식 관련 유전자의 조절은 알츠하이머 치매환자의 뇌안에서 아밀로이드 베타 (Aβ)를 효과적으로 제거하는데 작용하는 중요한 기전임을 증명함. [그림 2] 치매 환자 뇌조직에서 별세포 특이적으로 자가포식 유전자의 발현의 증가 양상을 확인함.
- 58
- 작성자뇌질환극복연구단
- 작성일2024.08.26
- 조회수10038
-
57
새로운 나노입자 개발, mRNA 백신의 안전성 높인다
- 이온화 지질의 함량 조정, 독성을 완화한 신규 지질 나노입자 조성 방법 개발 - 면역 관련 장기로의 표적 전달 확인, 향후 K-mRNA 백신 개발 기대 코로나-19 팬데믹 동안 개발된 mRNA 백신은 높은 예방 효과와 빠른 생산 속도로 인류의 안전을 지킨 현대 과학의 위대한 성취다. mRNA 백신은 바이러스의 유전 정보를 담은 메신저 리보핵산(mRNA)을 이용해 인체 내에서 항원을 직접 생성하게 함으로써 면역 반응을 유도하는 차세대 백신으로 알려져 있다. 다만, 백신 접종 후 발생하는 여러 부작용에 대한 원인이 정확히 밝혀지지 않아 신·변종 감염병에 대비한 국산 mRNA 백신 연구가 필수적이다. 한국과학기술연구원(KIST, 원장 오상록) 뇌융합기술연구단 방은경·금교창 박사팀은 가톨릭대학교 의생명과학과 남재환 교수팀, 서울대학교병원 핵의학과 윤혜원 교수팀과 공동연구를 통해 독성이 완화된 mRNA 백신용 신규 지질 나노입자 조성 방법을 개발했다고 밝혔다. 지질 나노입자를 구성하는 물질인 이온화 지질은 mRNA 백신의 약물 전달에 중추적인 역할을 하지만, 체내에서 독성을 유발할 수 있어 이를 완화하기 위한 연구가 수행되고 있다. 이온화 지질은 mRNA와의 정전기적 상호작용으로 지질 나노입자를 만들어 mRNA의 전달 및 방출을 조절한다. 현재 사용되는 이온화 지질은 mRNA의 방출에 유리한 고깔 형태의 구조이며, RNA로부터 합성된 항원 단백질을 항원으로 인지해 항체를 형성하는 면역 반응을 일으키도록 도와준다. 연구팀은 mRNA 백신의 독성을 완화하기 위해 이온화 지질에 상응하는 면역 증강 효과가 있으면서도 독성이 없는 트레할로스(trehalose) 당지질에 주목했다. 염증 완화 효과가 있다고 알려진 트레할로스는 수소결합을 통해 mRNA와 상호작용이 가능하며 불포화지방산을 도입해 고깔 형태의 구조로 합성할 수 있다. 또한, 트레할로스 당지질은 체내 면역 인자의 수용체와 결합하는 리간드(ligand)로 작용해 면역 증강 효과를 지닌다. 지질 나노입자 내 트레할로스 당지질의 함량을 조절한 결과, 전체 지질 중 이온화 지질의 함량을 기존 50%에서 25%로 줄이고 트레할로스 당지질을 25% 추가한 새로운 지질 나노입자 조성 방법을 개발했다. 신규 지질 나노입자를 mRNA 구조체 플랫폼과 결합해 인플루엔자 mRNA 백신으로서 효능을 검증한 결과, 기존 지질 나노입자와 동일한 수준의 중화항체가(價)를 보여 면역 증강 효과가 있음을 입증했다. 또한, 유효 농도의 10배 이상 고농도 백신을 쥐에 주입했을 때 아무것도 처리하지 않은 대조군 대비 심장 독성 및 간독성 지표에 차이가 없어 독성 완화 효과가 있음을 확인했다. 한편, 생체영상분석을 통해 백신 투여 방법에 따라 면역 관련 기관인 비장 및 림프절에 선택적으로 mRNA의 전달이 가능한 것을 관찰했다. 이는 타 장기로의 전달에 따른 부작용을 낮추면서 면역 효과를 높여 독성이 완화된 국산 mRNA 백신 개발을 위한 기초 기술로 활용될 것으로 기대된다. KIST 방은경 박사는 “트레할로스 당지질은 이온화 지질의 함량을 줄이고 표적화할 수 있어 독성을 완화할 수 있는 지질 나노입자의 주요 성분이 될 것”이라며 “면역 관련 장기에 표적 전달이 가능한 mRNA 백신 전달체는 전염병 예방 및 면역 항암 치료에 활용할 수 있다”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원을 받아 KIST 주요사업 및 바이오의료기술개발사업(2021M3E5E3080563) 등으로 수행됐다. 이번 연구 성과는 국제 학술지 「Bioactive Materials」 (IF 18.9, JCR 분야 1.1%) 최신 호에 게재됐다. * 논문명 : A lipid nanoparticle platform incorporating trehalose glycolipid for exceptional mRNA vaccine safety [그림 1] 트레할로스 당지질로 이온화 지질의 일부를 대체한 신규 지질 나노입자 플랫폼의 디자인 및 성능 모식도 [그림 2] 트레할로스 당지질로 이온화 지질의 일부를 대체한 신규 지질 나노입자 플랫폼의 디자인 및 성능 모식도 2
- 56
- 작성자뇌융합기술연구단
- 작성일2024.06.24
- 조회수17573
-
55
신경병증성 통증, 별세포에서 해답을 찾다
- 별세포에 의한 ‘지속적 흥분’ 유발이 신경병증성 통증의 핵심 기전으로 규명 - 신경병증성 통증 시각화를 통해 향후 진단 및 예후 모니터링 활용 기대 신경병증성 통증은 경미한 자극에도 극심한 통증을 느끼는 증상이다. 일반적으로 당뇨, 항암치료, 수술 등으로 인해 말초 신경이 손상되어 통증을 관장하는 뇌에서 잘못된 신호를 보내 통증을 유발하는 질환으로 알려져 있다. 심각할 경우, 옷에 쓸리는 느낌만으로도 불에 타는 듯한 극심한 통증을 느껴 삶의 질을 저하시키고 있다. 현재까지 신경병증성 통증을 유발하는 명확한 원인을 알지 못해 진단과 치료가 어려운 상황이다. 한국과학기술연구원(KIST, 원장 오상록) 뇌과학연구소 남민호 박사 연구팀은 광주과학기술원(GIST, 총장 임기철) 김형일 교수 연구팀과 공동연구를 통해 별세포(astrocyte)에 의한 신경병증성 통증 유발의 핵심 기전을 새롭게 규명하고, 나아가 그에 따른 맞춤형 치료 및 모니터링 타겟을 제시했다고 밝혔다. 신경세포를 중심으로 통증 신호의 전달을 조절하는 것에 집중돼 있던 기존 연구에서 벗어나 별세포를 중심으로 한 새로운 타겟을 제시한 것이다. 연구팀은 쥐 실험을 통해 신경병증성 통증 모델의 척수에서 반응성 별세포가 가바(GABA)를 과도하게 생성 및 분비하는 것이 병리의 핵심임을 밝혀냈다. 중추신경계의 신경전달물질인 가바는 일반적으로 주변 신경세포의 활성과 대사를 억제시키는 역할을 한다. 그러나 신경병증성 통증이 발병한 경우, 가바의 분비로 신경세포의 특정 단백질인 ‘KCC2 운송체’의 발현이 감소해 신경세포의 염화이온 농도가 높아진다. 따라서 역설적인 현상으로 신경세포를 과도하게 활성시키는 ‘지속적 흥분(Tonic Excitation)’ 현상을 일으킨다는 것을 확인했다. 또한, 연구팀은 방사성동위원소로 표지된 포도당(18F-FDG)을 이용한 PET(양전자단층촬영)을 통해서 별세포 가바에 의한 신경세포의 ‘지속적 흥분’을 시각화하는 데에 성공했다. 그 결과, 신경병증성 통증을 겪는 동물의 척수에서 증가된 포도당 대사를 관찰할 수 있었고, 별세포가 발현하는 마오비(MAOB) 효소를 활용해 가바 생성을 억제한 이후에는 척수에서의 포도당 대사도 정상 수준으로 회복되는 것을 관찰했다. 이는 치료의 진행 정도를 가시화할 수 있음을 보여 신경병증성 통증 환자의 예후 관리에 도움이 될 것으로 기대된다. 특히, 연구팀이 개발한 마오비(MOAB) 억제제의 신경병증성 통증 치료 효과 및 안정성을 확보하기 위해 임상실험을 진행할 예정이다. KIST 남민호 박사는 “별세포의 가바에 의한 지속성 흥분이 척수 신경 과민성의 원인이자 신경병증성 통증의 핵심 기전”이라며, “이러한 결과들은 신경병증성 통증의 새로운 치료 전략 개발을 위한 중요한 기초를 제공할 것이다”라고 말했다. GIST 김형일 교수는 “별세포와 신경세포 간 상호작용의 시각화를 통해 신경병증성 통증의 예후 모니터링에 중요한 정보를 제공할 수 있을 것”이라고 말했다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원으로 KIST 주요사업 및 뇌질환극복연구사업(2020M3E5D9079744), 세종과학펠로우십(2021R1C1C2005440) 등으로 수행됐다. 이번 연구 결과는 국제 학술지 'Experimental & Molecular Medicine' (IF 12.8, JCR 분야 4.8%) 최신호에 게재됐다. [그림 1] 별세포-신경세포 상호작용을 통한 신경병증성 통증의 신규 기전 [그림 2] 마오비 억제제에 의한 신경병증성 통증 치료 효과
- 54
- 작성자뇌기능연구단
- 작성일2024.06.19
- 조회수9002
-
53
퇴행성 뇌질환의 비밀 풀어줄 열쇠 찾았다.
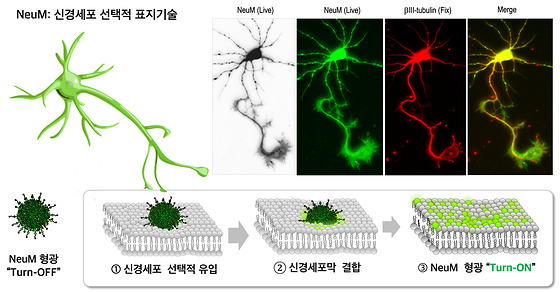
- 신경세포 구조를 세밀하게 관찰할 수 있는 뉴런 표지 기술 ‘NeuM’ 개발 - 최대 72시간 동안 신경세포의 변화 모니터링 성공 뇌졸중과 함께 3대 노인성 질환으로 꼽히는 알츠하이머 치매와 파킨슨병은 신경세포인 뉴런(Neuron)의 기능이상 및 점진적 퇴행으로 발병하는 신경계 질환이다. 이러한 신경계 질환의 발병기전을 규명하고, 치료제를 개발하기 위해서는 정상적 환경뿐만 아니라 질병 상태에서 뉴런의 변화를 시각화할 수 있는 표지(Labeling) 기술이 매우 중요하다. 한국과학기술연구원(KIST, 원장 윤석진) 뇌과학연구소 김윤경 박사 연구팀은 포항공과대학 장영태 교수 연구팀과 함께 차세대 뉴런 표지 기술인 NeuM을 개발했다고 밝혔다. NeuM(뉴엠, Neuronal Membrane-selective)은 신경세포막을 표지해 뉴런구조를 시각화하고 뉴런의 변화양상을 실시간으로 모니터링할 수 있는 차세대 뉴런 형광 표지 기술이다. 뉴런은 감각기관으로 받아들인 정보를 뇌로 전달해 생각, 기억, 행동을 조절하기 위해 구조와 기능을 지속해서 변화시킨다. 따라서 퇴행성 신경질환을 극복하기 위해서는 살아있는 뉴런을 선택적으로 표지해 실시간으로 모니터링하는 기술 개발이 필요하다. 하지만 뉴런을 관찰하기 위해 현재 가장 많이 사용하고 있는 유전자 기반 표지 기술과 항체 기반 표지 기술은 특정 유전자의 발현이나 단백질에 의존하기 때문에 정확성이 낮고 장기간 추적 관찰하는 데 어려움이 있었다. 연구팀이 신경세포의 분자 설계를 통해 개발한 NeuM은 신경세포막에 우수한 결합력을 갖고 있어 뉴런의 장기 추적관찰 및 고해상도 이미징이 가능하다. NeuM에 존재하는 형광 프로브(Probe)는 살아있는 세포의 활성을 이용해 신경세포막에 결합한 뒤 프로브 내의 형광 성분을 특정 파장의 빛으로 방출한다. 이를 통해 신경세포의 막을 시각화하면 신경세포 말단구조를 세밀하게 관찰할 수 있으며, 신경세포의 분화 및 신경세포 간 상호작용 또한 고해상도로 모니터링이 가능하다. NeuM은 살아있는 신경세포의 세포내이입(Endocytosis)을 통해 세포막을 염색하는 최초의 기술로 세포내이입이 없는 죽은 세포에는 반응하지 않는 선택성을 갖는다. 또한, 6시간에 불과했던 신경세포의 관찰 시간을 최대 72시간까지 늘리는 데 성공해 외부 환경 변화에 따라 살아있는 신경세포가 장시간 동안 어떤 동적인 변화 과정을 거치는지 포착할 수 있게 됐다. NeuM은 아직 치료제가 없는 퇴행성 신경질환의 연구와 치료법 개발에 실마리를 제공할 것으로 기대된다. 퇴행성 뇌질환은 아밀로이드와 같은 독성 단백질 생성 및 염증 물질의 유입으로 신경세포가 손상되어 발생하는데, NeuM은 신경세포의 변화를 더욱 정밀하게 관찰함으로써 치료 후보물질의 효능을 평가하는 데 효과적으로 활용될 수 있다. KIST 김윤경 박사는 “이번에 개발된 NeuM은 노화 및 질병으로 인해 퇴행하는 신경세포를 구분할 수 있어 퇴행성 뇌질환의 발생기전을 규명하고 치료법 개발에 중요한 도구가 될 것”이라며 “앞으로는 지금보다 더 정밀한 신경세포의 분석을 위해 형광 파장 제어설계를 통해 녹색, 빨강 등 색깔을 구분할 수 있도록 고도화할 계획”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원을 받아 KIST 주요사업과 치매극복 사업(RS-2023-00261784)으로 수행됐다. 이번 연구 성과는 국제 학술지 「Angewandte Chemie」에 최신 호에 게재됐다. [그림 1] NeuM의 신경세포막 선택적 형광 Turn-On 기술 [그림 2] 뉴런의 실시간 고해상도 시각화 기술인NeuM(뉴엠)을 개발한 KIST 김윤경 박사연구팀.
- 52
- 작성자뇌과학연구소
- 작성일2024.03.21
- 조회수10559
-
51
실명 유발하는 망막 질환 획기적으로 늦추는 치료법 개발
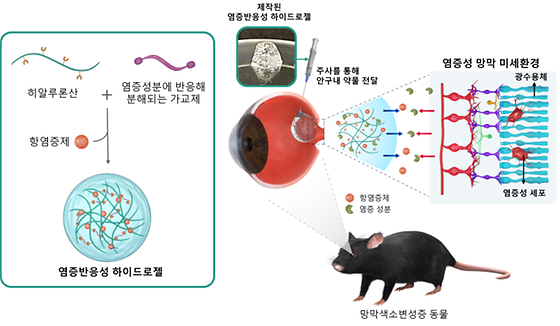
- 망막 내 염증 정도에 맞추어 약물 전달 속도를 자동으로 조절 - 환자 맞춤형 치료 방식 개발로 환자의 편의성 높일 것으로 기대 한국과학기술연구원(KIST, 원장 윤석진)은 뇌과학연구소 임매순 박사 연구팀은 경희대학교(총장 한균태) 오승자 교수, 서울대학교(총장 유홍림) 이강원 교수와 함께 망막 내 염증 환경을 억제할 수 있는 새로운 약물을 제안하고, 염증 부위에 약물을 효과적으로 전달할 수 있는 하이드로젤을 개발했다고 밝혔다. 노인성 황반변성과 망막색소변성은 안구 뒤편의 신경 조직인 망막에서 빛을 생체 신호로 변환하는 광수용체 세포가 점차 손상돼 실명을 초래하는 치명적인 안과 질환이다. 노인성 황반변성은 노화로 인해 망막 중앙 부분인 황반에서 변화가 일어나는 질환으로 65세 이상 노인의 실명 원인 1위로 꼽힌다. 이와 달리 망막색소변성은 망막 주변에서 광감각 세포의 변화가 일어나는 유전적인 질환으로 전세계적으로 약 4,000명 중의 1명 정도 발병하며, 초기에는 야맹증으로 시작되나 나중에는 시력을 잃어버리게 된다. 현재는 두 질환 모두 완치가 불가능하며, 항염증제를 안구 내에 주사해 망막 손상의 진행 속도를 늦추는 것이 최선의 방법이다. 그러나 약물 주사 방식은 약제가 안구 내에 머무르는 동안에만 효과가 지속되기 때문에 증상에 따라 4주에서 12주 간격으로 환자가 병원을 방문해 주사를 맞아야 하는 불편함이 있다. 연구팀은 염증 인자인 EZH2를 억제하는 물질을 항염증제로써 최초로 활용했다. EZH2는 광수용체 내에서 염증 반응을 유발해 망막 변성을 가속화하는데, 망막 변성을 앓고 있는 쥐에 항염증제를 주입하자 망막 변성의 진행 속도가 느려짐을 확인할 수 있었다. 그뿐만 아니라 일반적으로 염증 환경에서 과발현되는 효소인 카텝신(cathepsin) 인자와 만나면 서서히 분해되는 성질을 가진 하이드로젤에 항염증 약물을 실어 전달하는 데 성공했다. 연구팀이 개발한 염증 인자 반응성 항염증 약물 전달 하이드로젤을 망막 변성을 앓고 있는 쥐의 안구에 주입했을 때 망막 내 염증 인자가 6.1% 수준으로 감소했다. 또한, 망막 변성에 의해 파괴되는 것으로 알려진 광수용체 세포의 보호 효과가 대조군에 비해 약 4배 높아 시력 손실을 효과적으로 지연할 수 있음을 확인했다. 특히, 안구의 유리체 성분과 유사한 히알루론산 기반의 하이드로젤은 환자 개개인의 망막 염증 정도에 따라 약물이 분해되는 양을 다르게 조절할 수 있어 반복적 주사를 최소화할 수 있다. 이를 통해 시력 저하로 거동이 어려운 환자의 경우 통원 과정에서 발생하는 경제적 부담과 안전사고의 위험성을 낮추고, 증상 초기 환자는 주기적 병원 방문 횟수가 감소해 일상생활에서 불편함을 줄일 수 있다. KIST 임매순 박사는 "상용화를 위해 향후 질병 진행 정도에 따라 사용될 약물과 하이드로젤의 양, 치료 주기 등을 데이터화하고 약물 전달 시스템의 장기간 안정성도 검토할 예정"이라고 밝혔다. 경희대학교 오승자 교수는 “향후 망막 변성 질환 이외의 다양한 안과 질환에서 염증을 포함한 여러 인자의 변화를 조사해 새롭게 개발한 반응성 약물 전달 시스템을 순차적으로 적용해 나갈 것”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원으로 KIST 주요사업과 신진중견연계연구(RS-2023-00208795), 우수신진연구자지원사업(2020R1C1C1006065), 뇌기능규명조절기술개발사업(2022M3E5E8017395), 보건복지부(장관 조규홍)의 공익적의료기술연구사업(HI22C1394)을 통해 수행됐다. 이번 연구 성과는 국제 학술지 ‘npj Regenerative Medicine’(IF 7.2, JCR 분야 상위 19.3%)에 최신 호에 게재됐다. *논문명: Effective Protection of Photoreceptors Using an Inflammation -Responsive Hydrogel to Attenuate Outer Retinal Degeneration [그림 1] 망막 퇴행을 억제하기 위한 염증 반응성 약물 개념도 (왼쪽 초록색 박스) 염증에 반응하는 하이드로젤 안에 담겨있는 항염증제. (오른쪽) 제작된 염증 반응성 약물을 망막색소변성증 동물에 주사. 망막내 염증 성분에 반응하여 약물이 점진적으로 전달되면서 광수용체 부근에 존재하는 염증성 세포의 증식을 억제해 망막 변성 질환의 진행을 늦출 수 있음. [그림 2] 제작한 염증 반응성 약물의 효과 검증 결과 망막변성증을 가진 동물에 제작한 염증 반응성 약물을 주입하고 2주 후 망막을 관찰한 결과 (위) 약물을 주입하지 않은 대조군에 비해 실험군에서 염증 인자들 (초록색, 빨간색)이 유의미하게 감소한 것을 확인할 수 있었음 (아래) 광수용체 세포 중 한 종류인 원뿔 세포(초록색)가 실험군에서 더 많이 관찰되었으며, 광수용체 층도 더 많이 남아있는 것을 확인하였음. +) 파란색은 염색된 세포핵을 의미하며, 측정된 염증 정도와 원뿔세포 수는 염색된 세포핵을 기준으로 상대적으로 계산된 값임. 그래프 내 ***는 유의 수준이 0.001이하임을 의미함.
- 50
- 작성자뇌과학연구소 임매순 박사
- 작성일2024.01.21
- 조회수6533
-
49
‘뉴런-시냅스-뉴런’ 구조 블록처럼 쌓아 인공 신경망 하드웨어 시스템 구현
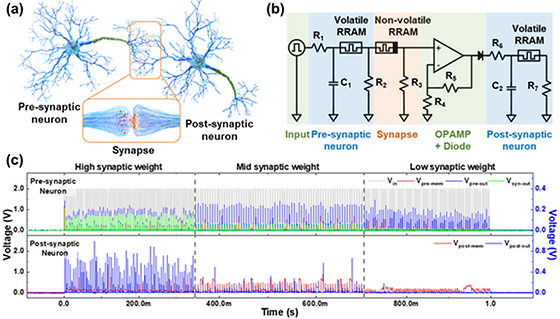
- 고성능·저전력 뉴로모픽 컴퓨팅을 위한 ‘뉴런-시냅스-뉴런’ 기본 단위 구조 하드웨어에서 구현 - 동일 물질, 동일 구조를 가져 공정 용이성과 네트워크 확장성 확보 최근 인공지능, 사물인터넷, 머신러닝 등 새로운 산업이 등장하면서 방대한 양의 데이터를 처리하면서도 에너지를 효율적으로 소비하는 차세대 인공지능 반도체 개발에 세계적 기업들이 역량을 집중하고 있다. 인간의 뇌에서 영감을 받은 뉴로모픽 컴퓨팅도 그중 하나다. 이에 따라 생물학적 뉴런과 시냅스를 모방한 소자들이 새로운 소재 및 구조를 기반으로 속속 개발되고 있으나, 개별 소자들을 통합해 시스템에서 검증하고 최적화하는 연구는 미비한 상황이다. 향후 대규모 인공 신경망 하드웨어가 실용화되기 위해서는 인공 뉴런과 시냅스 소자를 통합하는 것이 필수적이며, 동일 소재 및 구조로 소자를 제작해 양산 비용과 에너지 사용량을 절감할 필요가 있다. 이런 가운데 한국과학기술연구원 (KIST, 원장 윤석진) 인공뇌융합연구단 곽준영 박사 팀이 ‘레고 블록’처럼 뉴런과 시냅스를 연결해 대규모 인공 신경망 하드웨어를 구성할 수 있는 인공 신경 모사 소자의 통합 요소 기술을 구현했다고 밝혔다. 연구팀은 고집적화와 초저전력 구현에 유리한 2차원 물질인 hBN을 이용해 수직적층 구조의 멤리스터 소자를 제작함으로써 생물학적 뉴런과 시냅스와 유사한 특성을 구현했다. 연구팀이 개발한 소자는 동일 물질-동일 구조로 인공 뉴런 및 시냅스 소자를 설계했기 때문에 다수의 소자를 이용해 복잡한 구조를 가진 기존 실리콘 CMOS 기반의 인공 신경 모사 소자와 달리, 공정의 용이성과 네트워크 확장성을 확보해 대규모 인공 신경망 하드웨어 개발의 기반을 마련했다. 연구팀은 또한 개발한 소자를 통합, 연결해 인공 신경망의 기본 단위 블록인 ‘뉴런-시냅스-뉴런’ 구조도 하드웨어로 구현해 인간 뇌의 동작 방식인 스파이크 신호 기반 정보전달을 성공적으로 모사하는 데도 성공했다. 인공 시냅스 소자의 시냅스 가중치에 따라 두 뉴런 사이의 스파이크 신호 정보의 변조를 조절할 수 있음을 실험적으로 검증해 저전력, 대규모 인공지능 하드웨어 시스템에 hBN 기반 신소자의 활용 가능성을 보였다. KIST 곽준영 박사는 “인공 신경망 하드웨어 시스템은 향후 스마트 시티, 의료, 차세대 통신, 기상예보 및 자율주행 자동차와 같은 실생활에 밀접한 응용 분야에서 생성되는 방대한 양의 데이터를 효율적으로 처리하는 데 활용할 수 있을 것”이라면서, “기존 실리콘 CMOS 기반 소자의 확장 한계를 뛰어넘으면서도 에너지 사용량을 크게 줄여 탄소 배출과 같은 환경 문제 개선에도 도움이 될 것”이라고 연구성과의 의의를 설명했다. [그림 1] 시냅스 가중치에 따른 전단 및 후단 뉴런의 연결 강도 조절 실험 결과 (a) 생물학적 신경망의 개략도 및 (b) 인공 신경 모사 소자를 이용하여 하드웨어로 구현한 인공 신경망의 회로 개략도. (c) 시냅스 가중치 변화에 따른 두 뉴런 간의 연결 강도 변화 실험 결과. 시냅스 가중치가 낮아질수록 후단 뉴런의 발화 정도가 감소하는 것을 확인함. [그림 2] 2차원 물질 기반 휘발성 및 비휘발성 메모리 소자 (a) 2차원 물질 기반 휘발성 및 비휘발성 메모리 소자의 개략도 (상단) 및 제작한 소자의 전기적 특성 측정 결과 (하단) (b) 제작한 소자의 전자현미경 (상단) 및 투과전자현미경 사진 (하단). 제작한 소자를 활용하여 생물학적 뉴런 및 시냅스 특성을 구현함. ○ 논문명: Hardware Implementation of Network Connectivity Relationships Using 2D hBN-Based Artificial Neuron and Synaptic Devices ○ 학술지: Advanced Functional Materials ○ 게재일: 2023.11.05.(온라인) ○ DOI: https://doi.org/10.1002/adfm.202309058 ○ 논문저자 - 조유연 박사후연구원(제1저자/KIST 인공뇌융합연구단) - 곽준영 책임연구원(교신저자/KIST 인공뇌융합연구단)
- 48
- 작성자인공뇌융합연구단 곽준영 박사팀
- 작성일2023.12.21
- 조회수7965
-
47
KIST, 인간의 눈처럼 색을 구분하는 인공 신경회로 개발
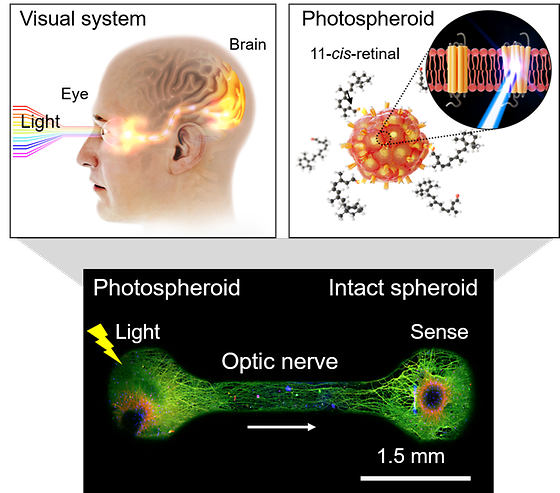
- 인간 시각과 유사한 감지 능력을 가진 신경 스페로이드 생산 - 색을 구분하여 빛 정보를 신경신호로 전달하는 생체 디바이스 사고에 의한 시각 손상, 황반변성, 당뇨성 등의 망막 질환으로 시각을 잃은 사람들에게 ‘인공 망막’ 기술은 새로운 희망이 되고 있다. 인공 망막 연구는 실제 인체에 적용하기 전 실험동물에 망막 질환이 발생하도록 유도한 후 인공 망막 기술의 효과성을 검증하는 과정을 거친다. 그런데 이 과정에서 적지 않은 연구비가 쓰이고, 냄새나 소리 등 시각 이외의 감각 정보로 인한 쥐 행동의 변화를 인공 망막에 의한 것으로 오인하는 등 예상치 못한 실험적 변수들이 발생하기도 한다. 한국과학기술연구원(KIST, 원장 윤석진)은 센서시스템연구센터 김재헌 박사, 송현석 박사팀과 뇌융합기술연구단 김홍남 박사팀이 생체 외 세포 실험을 통해 인간과 같은 수준의 시각 기능을 갖는 인공 광수용체를 제작하고, 이 인공 광수용체에서 빛을 받아 생산된 전기적 신호를 다른 신경세포로 전달하는 인공 시각회로 플랫폼을 개발했다고 밝혔다. 인간의 망막은 원추세포와 간상세포로 이루어져 있다. 원추세포는 빨강, 초록, 파란색 세 가지 색감을 구분하는 광수용체 단백질을 생산하고, 간상세포는 명암을 구분하는 광수용체 단백질을 생산한다. 인간의 눈은 외부에서 들어온 빛이 망막에서 맺혀 상을 형성하면, 시신경을 통해 뇌로 전달하는 과정을 통해 사물을 본다. 기존의 인공 망막 연구는 단일 신경세포에 전자천공법을 사용하거나 바이러스-유전자를 주입하는 방식을 사용했으나, 인공적으로 광수용체 단백질을 발현시키기 전에 신경세포가 기능을 잃거나 괴사하는 문제가 있었다. KIST 연구진은 신경세포의 기능성과 생존력을 높인 스페로이드 (spheroid)라는 세포 군집을 광수용체 발현을 위한 플랫폼으로 이용함으로써 세포 간 상호작용을 증대하여 안정적으로 인공 광수용체 단백질을 발현시키는 데 성공했다. 기존에는 2차원 세포배양 시 광수용체 단백질을 주입했을 때 50% 이하의 신경세포들만 생존했다면, 신경 스페로이드를 활용하면 80% 이상의 높은 생존율을 가지게 된다. KIST 연구진은 명암을 구분하는 로돕신(~490nm)과 색 구분을 위한 청색 옵신(~410nm) 단백질을 발현하여 각각 청색과 녹색에서 선택적인 반응성을 가지는 스페로이드를 제작했다. 연구진이 제작한 스페로이드는 사람의 눈이 인식하는 색과 동일한 파장에서 반응을 일으켰다. 그 후 눈을 모사한 광반응성 신경 스페로이드와 뇌를 모사한 일반 신경 스페로이드를 연결한 디바이스를 제작하고, 일반 스페로이드까지 신경전달이 확장되는 과정을 형광 현미경을 통해 포착하는 데 성공했다. 즉, 인간의 뇌가 어떤 과정에 의해 망막에서 발생한 신호를 다른 색으로 인지하는지 탐색이 가능한 시각신호 전달 모델을 만든 것이다. KIST 김재헌 박사는 “인공 광수용체의 시각신호 전달 가능성을 다각적으로 검증함으로써 동물실험 의존을 줄이고 연구비용을 절감할 수 있는 플랫폼”이라며, “앞으로 인간이 볼 수 있는 모든 색을 인식할 수 있는 스페로이드를 생산해 시각 관련 질환 및 치료에 대한 테스트 키트로 발전시킬 계획”이라고 밝혔다. 해당 연구는 KIST 내 부서 간 융합연구를 통해, 도전적이고 인류에 공헌하는 기술 개발을 목표로 하는 그랜드 챌린지(GRaND Challenge) 사업을 통해 개발되었다. 연구팀은 향후 사람의 망막 기능을 대체할 수 있는 인공 시스템 개발을 목표로 연구를 진행하고 있다. 이번 연구 결과는 국제 학술지 「Advanced Materials」에 게재되었다. [그림 1] 광반응성 신경세포 스페로이드 기반 눈-뇌 인간 시각 모사 모델 눈과 시신경, 뇌로 이어지는 사람의 시각 시스템을 하나의 디바이스안에 광반응성-신경세포(photospheroid) 스페로이드를 활용하여 모사한 모델을 제작함. 신경세포 안에 인간 광수용체 옵신 단백질을 생산하여 빛에 대한 반응성을 기능추가 하였고, 디바이스 안에 일반-신경세포(intact spheroid)와 배치하여 신경네트워크를 형성하였음. 왼쪽 광반응성-신경세포에 빛으로 자극하면, 신경돌기를 따라 일반-신경세포로 신경신호가 전달됨. ○ 논문명: Eye-mimicked neural network composed of photosensitive neural spheroids with human opsin proteins ○ 학술지: Advanced Materials ○ 게재일: 2023.06.28. ○ DOI: https://doi.org/10.1002/adma.202302996 ○ 논문저자 - 김재헌 책임연구원 (교신저자 / KIST 첨단소재기술연구본부 센서시스템연구센터) - 김홍남 책임연구원 (교신저자 / KIST 뇌과학연구소 뇌융합기술연구단) - 송현석 책임연구원 (교신저자 / KIST 첨단소재기술연구본부 센서시스템연구센터) - 박병호 선임연구원 (제1저자 / KIST 첨단소재기술연구본부 센서시스템연구센터) - 방석영 교수 (제1저자 / 동국대학교 의생명공학과) * * 연구 수행 당시, KIST 뇌과학연구소 뇌융합기술연구단 소속 박사후연구원 - 황경섭 박사과정 (제1저자 / /KIST 뇌과학연구소 뇌융합기술연구단) - 차연경 박사후연구원 (제1저자 / KIST 첨단소재기술연구본부 센서시스템연구센터)
- 46
- 작성자센서시스템연구센터 박병호 박사팀
- 작성일2023.09.18
- 조회수6841
-
45
빛으로 수돗물 속 미세플라스틱 잡아낸다
- 전기-광집게현상, 표면증강라만산란을 통해 초미세플라스틱 빠르게 검지 - 안전한 수자원 확보 기술로 적용 기대 최근 우리나라 주요 강의 미세플라스틱 농도가 세계에서 가장 높다는 연구결과가 발표되었다. 생활 속에서 간단히 마시는 티백제품에도, 마시는 물에도 미세플라스틱이 검출되었다는 뉴스를 쉽게 접할 수 있다. 미세플라스틱은 우리 생활 속 플라스틱이 폐기 후 생태계로 유입되어 물리적·화학적으로 쪼개져 마이크로~나노 크기로 존재하는 플라스틱으로 우리의 건강과 환경 전반에 미치는 영향이 매우 크다. 하지만 미세플라스틱, 그 중에서도 100nm 이하의 초미세플라스틱은 그 크기가 매우 작고 농도도 매우 낮기 때문에 검지에 한계가 있다. 나노 크기의 플라스틱 입자를 검지하기 위해서는 플라스틱 시료를 농축하는 전처리 과정에 수시간~수일에 걸친 시간과 많은 비용이 소요되기 때문이다. 한국과학기술연구원 (KIST, 원장 윤석진) 뇌융합기술연구단 유용상 박사 연구팀은 초미세 나노 플라스틱을 나노 사이즈의 금, 은 입자와 함께 전기-광집게를 이용해 짧은 시간 내 시료를 농축시키고, 빛을 이용한 실시간 검지시스템을 개발했다고 밝혔다. 연구진은 절연막을 사이에 두고 양면이 금속으로 된 대면적 3층 수직배열의 전극에 전기를 공급하고, 동시에 분자의 진동수에 따른 입사광과 산란광의 에너지 차이를 분석하는 라만 광검지 방식을 채택했다. 이 과정에서 나노 사이즈의 금, 은 입자인 플라즈모닉 나노입자를 활용해 시료를 농축했으며, 그 결과 미세플라스틱 검지를 위해 필요한 농축, 검지시간을 수 초로 줄일 수 있었다. 실제 실험에서 10μg/L 농도의 30nm 크기 폴리스티렌 입자를 검지하는데 성공해 초저농도 실시간 나노플라스틱의 광검지 성능을 확인했다. 한편, 연구진은 유전영동(Dielectrophoresis) 현상을 이용해 시료에서 입자를 쉽게 분리해냈다. 이를 통해 기존에 나노플라스틱 분석을 위해 채집 (collection), 분류 (separation), 분석(analysis)까지 하루 이상이 걸리던 전 과정을 하나의 플랫폼 안에서 실시간으로 1초 단위로 분리 및 검지 가능한 원천기술을 확보할 수 있었다. 본 연구를 수행한 KIST 정의태 연구원과 유의상 박사(이상 공동 주저자)는 “미세플라스틱의 실시간 초고감도 검지가 가능해졌다는데 이번 연구성과의 의의가 있으며, 향후 연구 결과를 확장해 실제 여러 수자원의 미세플라스틱 농도를 측정하고 안전한 수자원 확보 기술로의 활용을 기대하고 있다.”고 말했다. 본 연구는 과학기술정보통신부(장관 이종호)지원을 받아 KIST 주요사업으로 수행되었으며, 연구결과는 국제 학술지인 「ACS Nano」 (IF : 18.027) 최신호에 표지논문으로 게재되었다. * (논문명) Real-time Underwater Nanoplastic Detection Beyond Diffusion Limit and Low Raman Scattering Cross-section via Electro-photonic Tweezers - (제 1저자) 한국과학기술연구원 정의태 학생연구원 - (제 1저자) 한국과학기술연구원 유의상 박사후연구원 - (교신저자) 한국과학기술연구원 유용상 책임연구원 ※ 논문 주소: https://doi.org/10.1021/acsnano.2c07933 [그림1] ACS Nano 전면 표지 선정 [그림 2] 전기-광 집게 현상 및 표면증강라만현상을 이용한 나노플라스틱 라만 광검지 메커니즘과 이에 따른 축적시간 감소 및 광신호 증폭 오른쪽 위: 이에 따른 축적시간 감소 모식도 (파란색: 기존, 빨간색: 본 연구) 오른쪽 아래: 이에 따른 광신호 증폭 모식도 (파란색: 기존, 빨간색: 본 연구)
- 44
- 작성자뇌융합기술연구단 유용상 책임연구원
- 작성일2023.02.16
- 조회수9328
-
43
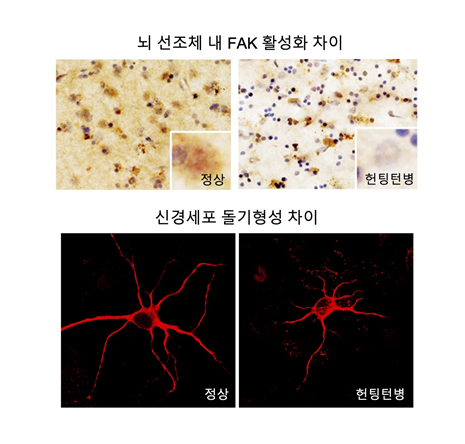
헌팅턴병 환자의 뇌기능 장애 원인 발견
- KIST, 환자 뇌조직에서 시냅스 기능에 중요한 단백질 기능 저하 발견 - 헌팅턴병 시냅스 기능장애 회복 치료에 활용 모색 헌팅턴병(Huntington’s disease)은 헌팅틴(huntingtin) 유전자에 돌연변이가 생겨 발생하는 유전성 뇌질환이다. 보통 40세 전후에 발병한 후, 조절되지 않는 경련성 신체 움직임과 함께 성격변화, 치매 증상을 일으키며 결국 사망에 이르게 하지만 아직까지 치료법이 없는 퇴행성 뇌질환이다. 헌팅턴병 진행과정에서 뇌기능에 중요한 시냅스에 문제가 생기기 시작하고, 병이 진행되면서 결국 뇌의 선조체 부위 뇌세포가 파괴되어, 이러한 헌팅턴병 증상들을 일으킨다고 알려져 있다. 하지만 헌팅턴병 진행과정 중 뇌기능 장애 기전은 아직 정확히 밝혀지지 않았다. 한국과학기술연구원(KIST, 원장 윤석진) 뇌과학연구소 성지혜 책임연구원과 류훈 책임연구원 연구팀은 헌팅턴병 환자 뇌 조직에서 신경돌기 운동성 및 정상적인 시냅스 형성에 중요한 역할을 하는 FAK(Focal adhesion kinase) 단백질 활성이 현저히 감소하는 것을 발견했다고 밝혔다. 정상적인 뇌에서 활성화된 FAK 단백질은 신경돌기 운동성 및 정상적인 시냅스 형성에 필수적이기 때문에 뇌기능에 중요한 역할을 한다. KIST 연구진은 헌팅턴 세포 및 동물모델, 그리고 실제 헌팅턴 환자 뇌 조직까지 다양한 시스템에서 FAK 단백질 활성이 현저히 감소하는 것을 확인했다. 특히 이러한 결과를 형광공명에너지전달현상(Fluorescence Resonance Energy Transfer, FRET) 기반 형광분자센서를 통해 살아있는 세포에서 FAK 활성을 정확히 측정하여 검증했다. FAK 단백질이 정상적으로 활성화하기 위해서는 세포막에 존재하는 인지질 중 PIP2(phosphatidylinositol 4,5-biphosphate)가 필수적이다. 연구진은 초고해상도 형광 현미경(Super-resolved structured illumination microscopy)을 이용하여, 헌팅턴병 세포에서 PIP2가 돌연변이 헌팅틴 단백질과 비정상적으로 강하게 결합하면서 세포막내 정상적으로 분포하지 못하는 것을 발견했다. 헌팅턴병에서 이러한 비정상적 PIP2 분포는 FAK 단백질이 활성화 되는 것을 저해하고, 감소된 FAK 단백질 활성은 결국 정상적인 시냅스 기능을 방해하여 헌팅턴병 초기의 뇌기능장애의 원인이 된다. 성지혜 책임연구원은 “본 연구를 통해 밝혀낸 헌팅턴병 환자의 시냅스 기능장애 병리기전은 헌팅턴병 진행과정에서 뇌기능 장애 회복을 위한 치료 타겟으로 활용될 수 있을 것으로 기대한다”고 말했다. 류훈 책임연구원은 “이번 연구 결과는 헌팅턴 환자의 뇌 조직에서 발견한 병리기전이기 때문에 실제 인간의 퇴행성 뇌질환에서 새로운 치료 타겟을 제시하는데 큰 의미가 있다”고 전했다. 본 연구는 과학기술정보통신부(장관 이종호) KIST 주요사업과 한국연구재단 중견연구자지원사업, 삼성미래기술육성사업으로 수행하였으며, 연구 결과는 국제 학술지인 Acta Neuropathologica [IF : 17.088, JCR(%) : 1.648 %] 최신호에 게재됐다. * (논문명) Decreased FAK activity and focal adhesion dynamics impair proper neurite formation of medium spiny neurons in Huntington’s disease - (제1저자) 한국과학기술연구원 이해님 학생, 현승재 박사후연구원 - (교신저자) 한국과학기술연구원 성지혜, 류훈 책임연구원 그림 설명 [그림 1] 정상 및 헌팅턴병 환자의 뇌조직 내 FAK 활성화 정도 및 신경세포 돌기형성 차이 [그림 2] 돌연변이 헌팅틴의 인지질 분포변화를 통한 FAK 활성저해 기전
- 42
- 작성자뇌과학창의연구단 성지혜 박사팀
- 작성일2022.08.28
- 조회수9937
-
41
암세포의 면역반응성을 바꾸는 차세대 면역항암제
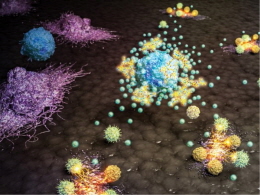
- 선천면역 활성화를 통해 암세포가 면역세포에 더 잘 반응하게 유도 - 다양한 면역항암 병용요법 치료제 개발로 응용 기대 면역항암제는 화학요법, 표적치료제를 잇는 새로운 항암제로 환자의 생존율을 획기적으로 증가시키며 혁신적인 임상적인 성공을 이루어냈다. 그러나 암세포의 낮은 면역반응성은 면역항암제 그중에서도 특히 면역관문억제제에 대한 반응률을 낮추는 원인으로 여겨지고 있다. 이에 많은 글로벌 제약회사들은 암의 면역반응성과 암세포 주변으로 면역세포의 침투를 높이기 위한 전략으로 STING이라는 선천면역 조절 단백질을 주목하고 있다. 그러나 가장 먼저 임상이 진행되었던 STING 작용제인 ADU-S100이라는 물질이 2020년 임상에서 중단되면서 새로운 작용제 개발이 시급한 실정이다. 이러한 가운데 한국과학기술연구원 (KIST, 원장 윤석진) 뇌과학창의연구단 이상희 박사, 한국화학연구원 (KRICT, 원장 이미혜) 감염병치료제연구센터 김혜진 박사 연구팀은 저분자화합물 기반의 새로운 STING 작용제를 개발했다고 밝혔다. 이 물질은 STING 단백질 활성화를 통해 인터페론 등의 사이토카인을 생성하였고, 이를 통해 T세포를 매개로 한 선천면역 반응을 유도하였다. 활성화된 선천면역 반응은 종양의 면역표현형을 바꿔 T세포에 대한 반응성이 낮은 ‘Cold tumor’를 반응성이 높은 ‘Hot tumor’로 변화시켰다. 이는 T세포가 암세포에 잘 침투할 수 있는 환경을 만들었으며 그 결과 동물모델에서 암세포의 성장을 효과적으로 억제했다. 특히 투여군의 20%는 암세포가 완전히 사라졌으며, 암세포를 재이식하여 암이 재발하는 환경을 유도하여도 추가적인 약물 투여없이 암세포 성장이 억제되거나 아예 자라지 않는 매우 우수한 항암 효능을 나타냈다. 또한 기존의 STING 작용제는 물질은 종양에 직접 투여하는 방법으로만 투여가 가능했기 때문에 매우 제한적인 암종에만 적용할 수 있었으나, 본 연구팀이 개발한 물질은 정맥 내 투여가 가능함으로 이러한 한계를 극복했다. 이번 연구 결과는 추가적인 신약개발 연구를 통해 방사선치료, 화학요법 등 기존 표준치료와 연계된 병용 치료요법, 나아가 항암을 위한 단독 투여로 활용될 수 있을 것으로 기대된다. KIST 이상희 박사는 “모두가 암의 정복을 꿈꾸고 있지만, 아직도 항암제 개발이 제한적인 분야가 많다. 이 연구가 뇌종양 등 임상에서 면역항암제 적용이 제한적인 암에 대한 새로운 치료전략 개발의 기반이 되기를 바란다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 KIST 주요사업, 한국화학연구원 주요사업과 한국연구재단 신진연구자지원사업 및 인공지능신약개발사업으로 수행되었으며, 연구 결과는 의약화학 분야 국제학술지 ‘Journal of Medicinal Chemistry’ (의약화학 분야 1위) 최신 호에 게재되었으며 Supplementary cover로 선정되었다. * (논문명) Development of Potent Immune Modulators Targeting Stimulator of Interferon Genes Receptor - (제 1저자) 한국화학연구원 전민재, 한국과학기술연구원 이혜림 학생 - (교신저자) 한국과학기술연구원 이상희, 한국화학연구원 김혜진 선임연구원 그림 설명 J. Med. Chem. supplementary 커버 이미지. 본 연구에서 개발한 물질이 면역세포를 자극시켜 선천면역 반응을 활성화시키고 암세포 사멸을 유도하는 모식도 본 연구에서 개발한 STING 작용제 4c의 화학적 구조 및 작용 기전 (왼쪽)과 동물모델에서 항암 효능 결과 및 모식도 (오른쪽)
- 40
- 작성자뇌과학창의연구단 이상희 박사팀
- 작성일2022.04.19
- 조회수24228



![[그림 1] 트레할로스 당지질로 이온화 지질의 일부를 대체한 신규 지질 나노입자 플랫폼의 디자인 및 성능 모식도](/app/board/attach/image/thumb_13907_1719188760000.do)
![[그림 1] 별세포-신경세포 상호작용을 통한 신경병증성 통증의 신규 기전](/app/board/attach/image/thumb_13899_1718784354000.do)
![[그림1] ACS Nano 전면 표지 선정](/app/board/attach/image/thumb_11106_1676523936000.do)